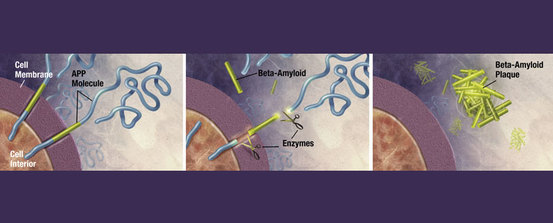
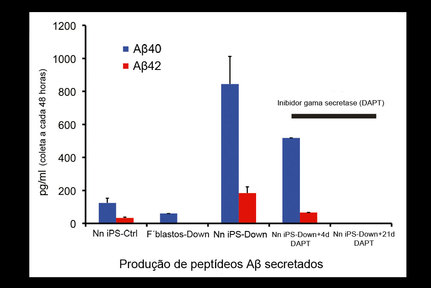
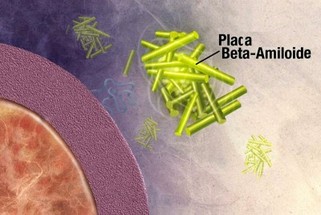
Textos
Cientistas apostam em células-tronco em pesquisa para curar cegueira - BBC - 29/09/2015
A cirurgia faz parte de um projeto criado há uma década para tentar reverter a perda de visão em pacientes com degeneração macular. Dez pacientes com o tipo "úmido" da doença, considerado o mais grave, participarão dos testes.
Todos eles têm expectativa de sofrer perda súbita de visão por conta de defeitos nos vasos sanguíneos localizados nos olhos.
Após a cirurgia, os pacientes serão monitorados por um ano para que se cheque se o tratamento é seguro e se houve melhora de visão.
Veja a matéria na íntegra aqui: http://www.bbc.com/portuguese/noticias/2015/09/150929_saude_cegueira_celula_tronco_fd_
Todos eles têm expectativa de sofrer perda súbita de visão por conta de defeitos nos vasos sanguíneos localizados nos olhos.
Após a cirurgia, os pacientes serão monitorados por um ano para que se cheque se o tratamento é seguro e se houve melhora de visão.
Veja a matéria na íntegra aqui: http://www.bbc.com/portuguese/noticias/2015/09/150929_saude_cegueira_celula_tronco_fd_
Células do câncer são reprogramadas para voltarem ao normal - Exame - 26/08/2015
São Paulo - Uma equipe da Mayo Clinic, um hospital-universidade sem fim lucrativos, acredita ter encontrado uma chave para tratar todos os tipos de câncer, reprogramando as células para fazê-las voltar ao normal. E já testaram, com sucesso, em células cancerosas in vitro.
Funciona assim: quando uma célula está em contato com outra, moléculas chamadas micro-RNAs (miRNAs) regulam a ação dos genes, dando a ordem que é hora da célula parar de se reproduzir. Esse contato, afinal, significa que o espaço já está ocupado.
Veja a matéria na íntegra aqui: http://exame.abril.com.br/tecnologia/noticias/celulas-do-cancer-sao-reprogramadas-para-voltarem-ao-normal
Funciona assim: quando uma célula está em contato com outra, moléculas chamadas micro-RNAs (miRNAs) regulam a ação dos genes, dando a ordem que é hora da célula parar de se reproduzir. Esse contato, afinal, significa que o espaço já está ocupado.
Veja a matéria na íntegra aqui: http://exame.abril.com.br/tecnologia/noticias/celulas-do-cancer-sao-reprogramadas-para-voltarem-ao-normal
Pesquisa brasileira usa células-tronco para tratar mal de Parkinson - O Globo - 03/04/2015
Camundongos tiveram melhora de função motora após tratamento com células embrionárias associadas a droga anticâncer.
RIO - Pesquisadores brasileiros deram o que eles descrevem como um importante passo rumo ao uso de células-tronco para tratar o mal de Parkinson. Usando uma substância para combater o câncer de estômago, o neurocientista da UFRJ e do Centro D’or, Steven Rehen, e seus colegas conseguiram criar neurônios produtores de dopamina a partir de células-tronco embrionárias. Elas continuaram saudáveis e funcionais pelos 15 meses de experimento, após sua introdução em camundongos. O resultado foi a restauração da função motora dos animais, sem a formação de tumores.
A doença de Parkinson, que atinge mais de dez milhões de pessoas no mundo, é causada pela degeneração e morte de neurônios produtores de dopamina no cérebro. Tratamentos atuais incluem medicações e implantes elétricos, que causam fortes efeitos colaterais e não conseguem impedir a progressão da doença. Vários estudos indicaram que o uso de células-tronco embrionárias melhoram as funções motoras em modelos animais. Entretanto, até agora, o procedimento se mostrou inseguro, devido ao risco de tumores durante o processo.
Para revolver o problema, os pesquisadores testaram usar células-tronco dos camundongos com mitomicina C (MMC), uma droga já prescrita contra câncer. A substância bloqueia a replicação do DNA e previne que as células se multipliquem descontroladamente.
Durante os testes, os camundongos eram separados em três grupos. O primeiro, o grupo de controle, não recebia as células-tronco. O segundo grupo recebia as células sem a MMC, enquanto que o terceiro recebia o tratamento completo. Os animais do segundo grupo mostraram melhora das funções motoras, mas todos morreram entre três e sete semanas. Esses animais desenvolveram tumores intracerebrais. Por outro lado, os animais com células-tronco tratadas com MMC tiveram melhora dos sintomas de Parkinson e sobreviveram até o final da observação de 12 semanas. Quatro desses ratos foram monitorados pelo período de 15 meses e não tiveram sinais da patologia.
Além disso, os cientistas mostraram que tratar as células-tronco com MMC aumentou em quatro vezes a liberação de dopamina.
— Esta estratégia simples, que é expor as células pluripotentes a uma droga anticâncer, tornou o transplante seguro, ao eliminar o risco de formação de tumor — afirma o autor principal do estudo, Rehen.
A descoberta, publicada na edição de abril do periódico “Frontiers in Cellular Neuroscience”, poderia abrir portas para testes em humanos.
— Nossa técnica com MMC pode acelerar a proposta de ensaios clínicos com células pluripotentes para várias doenças humanas — afirmou. — É o primeiro passo para tornar este tipo de tratamento com células-tronco possível.
O GLOBO
Veja a matéria na íntegra aqui
RIO - Pesquisadores brasileiros deram o que eles descrevem como um importante passo rumo ao uso de células-tronco para tratar o mal de Parkinson. Usando uma substância para combater o câncer de estômago, o neurocientista da UFRJ e do Centro D’or, Steven Rehen, e seus colegas conseguiram criar neurônios produtores de dopamina a partir de células-tronco embrionárias. Elas continuaram saudáveis e funcionais pelos 15 meses de experimento, após sua introdução em camundongos. O resultado foi a restauração da função motora dos animais, sem a formação de tumores.
A doença de Parkinson, que atinge mais de dez milhões de pessoas no mundo, é causada pela degeneração e morte de neurônios produtores de dopamina no cérebro. Tratamentos atuais incluem medicações e implantes elétricos, que causam fortes efeitos colaterais e não conseguem impedir a progressão da doença. Vários estudos indicaram que o uso de células-tronco embrionárias melhoram as funções motoras em modelos animais. Entretanto, até agora, o procedimento se mostrou inseguro, devido ao risco de tumores durante o processo.
Para revolver o problema, os pesquisadores testaram usar células-tronco dos camundongos com mitomicina C (MMC), uma droga já prescrita contra câncer. A substância bloqueia a replicação do DNA e previne que as células se multipliquem descontroladamente.
Durante os testes, os camundongos eram separados em três grupos. O primeiro, o grupo de controle, não recebia as células-tronco. O segundo grupo recebia as células sem a MMC, enquanto que o terceiro recebia o tratamento completo. Os animais do segundo grupo mostraram melhora das funções motoras, mas todos morreram entre três e sete semanas. Esses animais desenvolveram tumores intracerebrais. Por outro lado, os animais com células-tronco tratadas com MMC tiveram melhora dos sintomas de Parkinson e sobreviveram até o final da observação de 12 semanas. Quatro desses ratos foram monitorados pelo período de 15 meses e não tiveram sinais da patologia.
Além disso, os cientistas mostraram que tratar as células-tronco com MMC aumentou em quatro vezes a liberação de dopamina.
— Esta estratégia simples, que é expor as células pluripotentes a uma droga anticâncer, tornou o transplante seguro, ao eliminar o risco de formação de tumor — afirma o autor principal do estudo, Rehen.
A descoberta, publicada na edição de abril do periódico “Frontiers in Cellular Neuroscience”, poderia abrir portas para testes em humanos.
— Nossa técnica com MMC pode acelerar a proposta de ensaios clínicos com células pluripotentes para várias doenças humanas — afirmou. — É o primeiro passo para tornar este tipo de tratamento com células-tronco possível.
O GLOBO
Veja a matéria na íntegra aqui
 Pesquisadora Rafaela Sartore do LaNCE-UFRJ - Foto de Ana Branco
Pesquisadora Rafaela Sartore do LaNCE-UFRJ - Foto de Ana Branco
Organoides mostram o desenvolvimento de doenças como esquizofrenia e autismo
RIO - Vistas de longe, elas parecem apenas bolhas dentro de um frasco vermelho. No microscópio, porém, estas estruturas de apenas dois milímetros trazem uma contribuição imensurável para a ciência. As pequenas fôrmas são minicérebros, como foram apelidados os organoides cerebrais humanos criados na Áustria em 2013 e que, agora, aterrissaram no Brasil, onde estão sendo usados em um estudo pioneiro sobre a esquizofrenia. A doença, assim como o autismo, está entre as que podem ter tratamentos desenvolvidos a partir dessas análises.
Pesquisador do Instituto D'Or de Pesquisa e Ensino, Stevens Rehen destaca que os organoides são equivalentes ao cérebro de um feto de três meses. Trata-se, então, de uma oportunidade de acompanhar detalhadamente o desenvolvimento do órgão desde praticamente a estaca zero.
Outro importante diferencial do estudo é proporcionar pela primeira vez a análise tridimensional do cérebro.
— É uma nova maneira de olhar para nosso próprio interior — ressalta o neurocientista. — Este fantástico modelo abre possibilidades para estudar em tempo real aquilo que acontece durante a formação do cérebro, incluindo alterações de desenvolvimento cujas consequências irão se manifestar mais adiante na vida.
Diversos grupos de pesquisa já criaram pequenas réplicas do fígado e do intestino, entre outras estruturas do organismo, mas até 2013 ainda não haviam conseguido realizar o mesmo com o cérebro, o órgão mais complexo do ser humano. A intenção não é reproduzi-lo por completo, e sim obter um tecido que já seja suficiente para investigar o desenvolvimento do sistema nervoso e a origem de algumas doenças neurológicas.
Até agora, só havia duas possibilidades de estudar a esquizofrenia: em animais com cérebros menos complexos, como camundongos, ou em humanos mortos — ou seja, no estágio final da doença. Mas ainda não era possível saber como ocorre o início do transtorno cerebral. Com os minicérebros, é possível estudar em tempo real eventuais alterações de desenvolvimento.
A equipe do neurocientista formou os minicérebros com a conversão de células extraídas da pele, do sangue ou da urina em células-tronco pluripotentes — aquelas que podem se transformar em qualquer célula do corpo humano, assim como as encontradas no embrião.
— Colocamos estas células-tronco reprogramadas em um frasco de vidro que está sempre em movimento — descreve Rehen. — Este material recebe muitos estímulos, se agrupa e cresce, transformando-se em pequenos organoides cerebrais, de cerca de dois milímetros de tamanho.
REAÇÃO A SUBSTÂNCIAS
A “mistura” constante dos organoides no frasco proporciona aos cientistas testemunhar os principais processos biológicos e de que modo eles podem ser alterados. Por exemplo, como o cérebro reagiria com a introdução de uma determinada substância.
Como cada paciente cede as suas próprias células, a análise dos organoides é individualizada — ou seja, aquilo que vemos um frasco vem de apenas para uma pessoa.
A formação do minicérebro ainda é um processo demorado. São necessários seis meses para cumprir o caminho que começa na reprogramação de uma célula até o fim de seu estudo no frasco. Rehen espera concluir os primeiros organoides ainda este mês.
Além da esquizofrenia, a equipe brasileira dedica-se à produção de organoides de crianças com síndrome de Dravet, como é conhecida a epilepsia severa infantil. Esta pesquisa pode detalhar a formação do transtorno nos pacientes, além de contribuir para a busca por novas formas de tratamento.
Em estudo publicado em agosto de 2013 na revista “Nature”, cientistas do Instituto de Biotecnologia Molecular de Viena afirmaram que a baixa capacidade do minicérebro de armazenar sangue limitava o desenvolvimento de um exemplar maior do órgão. No entanto, o autor chefe da pesquisa, Jürgen Knoblich, afirmou que este procedimento ainda “não seria desejável”. O cientista também ressaltou que há um longo caminho a ser traçado até que um organoide desenvolvido no laboratório possa substituir um tecido cerebral.
Jornal O Globo
Veja a matéria completa aqui.
RIO - Vistas de longe, elas parecem apenas bolhas dentro de um frasco vermelho. No microscópio, porém, estas estruturas de apenas dois milímetros trazem uma contribuição imensurável para a ciência. As pequenas fôrmas são minicérebros, como foram apelidados os organoides cerebrais humanos criados na Áustria em 2013 e que, agora, aterrissaram no Brasil, onde estão sendo usados em um estudo pioneiro sobre a esquizofrenia. A doença, assim como o autismo, está entre as que podem ter tratamentos desenvolvidos a partir dessas análises.
Pesquisador do Instituto D'Or de Pesquisa e Ensino, Stevens Rehen destaca que os organoides são equivalentes ao cérebro de um feto de três meses. Trata-se, então, de uma oportunidade de acompanhar detalhadamente o desenvolvimento do órgão desde praticamente a estaca zero.
Outro importante diferencial do estudo é proporcionar pela primeira vez a análise tridimensional do cérebro.
— É uma nova maneira de olhar para nosso próprio interior — ressalta o neurocientista. — Este fantástico modelo abre possibilidades para estudar em tempo real aquilo que acontece durante a formação do cérebro, incluindo alterações de desenvolvimento cujas consequências irão se manifestar mais adiante na vida.
Diversos grupos de pesquisa já criaram pequenas réplicas do fígado e do intestino, entre outras estruturas do organismo, mas até 2013 ainda não haviam conseguido realizar o mesmo com o cérebro, o órgão mais complexo do ser humano. A intenção não é reproduzi-lo por completo, e sim obter um tecido que já seja suficiente para investigar o desenvolvimento do sistema nervoso e a origem de algumas doenças neurológicas.
Até agora, só havia duas possibilidades de estudar a esquizofrenia: em animais com cérebros menos complexos, como camundongos, ou em humanos mortos — ou seja, no estágio final da doença. Mas ainda não era possível saber como ocorre o início do transtorno cerebral. Com os minicérebros, é possível estudar em tempo real eventuais alterações de desenvolvimento.
A equipe do neurocientista formou os minicérebros com a conversão de células extraídas da pele, do sangue ou da urina em células-tronco pluripotentes — aquelas que podem se transformar em qualquer célula do corpo humano, assim como as encontradas no embrião.
— Colocamos estas células-tronco reprogramadas em um frasco de vidro que está sempre em movimento — descreve Rehen. — Este material recebe muitos estímulos, se agrupa e cresce, transformando-se em pequenos organoides cerebrais, de cerca de dois milímetros de tamanho.
REAÇÃO A SUBSTÂNCIAS
A “mistura” constante dos organoides no frasco proporciona aos cientistas testemunhar os principais processos biológicos e de que modo eles podem ser alterados. Por exemplo, como o cérebro reagiria com a introdução de uma determinada substância.
Como cada paciente cede as suas próprias células, a análise dos organoides é individualizada — ou seja, aquilo que vemos um frasco vem de apenas para uma pessoa.
A formação do minicérebro ainda é um processo demorado. São necessários seis meses para cumprir o caminho que começa na reprogramação de uma célula até o fim de seu estudo no frasco. Rehen espera concluir os primeiros organoides ainda este mês.
Além da esquizofrenia, a equipe brasileira dedica-se à produção de organoides de crianças com síndrome de Dravet, como é conhecida a epilepsia severa infantil. Esta pesquisa pode detalhar a formação do transtorno nos pacientes, além de contribuir para a busca por novas formas de tratamento.
Em estudo publicado em agosto de 2013 na revista “Nature”, cientistas do Instituto de Biotecnologia Molecular de Viena afirmaram que a baixa capacidade do minicérebro de armazenar sangue limitava o desenvolvimento de um exemplar maior do órgão. No entanto, o autor chefe da pesquisa, Jürgen Knoblich, afirmou que este procedimento ainda “não seria desejável”. O cientista também ressaltou que há um longo caminho a ser traçado até que um organoide desenvolvido no laboratório possa substituir um tecido cerebral.
Jornal O Globo
Veja a matéria completa aqui.
Diagnóstico RNTC 2013
Foi realizado um diagnóstico sobre o perfil, linhas de pesquisa e publicações dos laboratórios vinculados à RNTC, bem como os rumos que cada um para o futuro.
| diagnstico_rntc.pdf | |
| File Size: | 2482 kb |
| File Type: | |
Chineses recriam 'dente' a partir da urina humana - BBC Brasil - 30/07/2013
Cientistas chineses criaram dentes rudimentares a partir de algo que poderia ser considerado improvável: a urina humana.
O resultado do estudo, apresentado pela publicação científica Cell Regeneration Journal, mostrou que a urina pode ser utilizada como fonte de células-tronco que seriam capazes de se transformar em pequenas estruturas parecidas com os dentes humanos.
O time de cientistas da China espera que a técnica possa ser desenvolvida para possibilitar a reposição de dentes perdidos.
No entanto, outros pesquisadores de células-tronco ponderam que para atingir esse objetivo muitos obstáculos ainda precisam ser vencidos.
Times de pesquisadores em todo o mundo estão estudando maneiras criar novos dentes para repor aqueles perdidos pela idade ou por má higiene bucal.
Urina
As células-tronco, que são as células capazes de se transformar em qualquer outro tipo de tecido, são assunto popular de pesquisas.
Os pesquisadores do Guangzhou Institutes of Biomedicine and Health, na China, utilizaram a urina como ponto de partida para seus experimentos.
Células que normalmente são expelidas pelo corpo, através do sistema urinário, foram alteradas em para que se tornassem células-tronco.
Uma mistura dessas células com outros materiais orgânicos retirados de ratos foi então implantada nos próprios roedores.
Os cientistas chineses afirmaram que depois de três semanas o grupo de células começou a se parecer com um dente: "a estrutura parecida com o dente continha polpa dental, dentina, espaço de esmalte (área vazia do dente que possivelmente poderia ser ocupada pelo esmalte) e órgão de esmalte (estrutura que precede o surgimento do esmalte no dente)".
Entretanto, o dente criado pelos chineses não era tão rígido quanto um dente natural.
Mas ainda que o resultado do estudo chinês não venha a ser utilizado pelos dentistas como uma opção viável, seus pesquisadores defendem que pode nortear pesquisas mais aprofundadas para se chegar ao "sonho final de total regeneração do dente humano para terapia clínica".
Fonte inadequada
Para o professor Chris Mason, da University College of London (UCL), a urina utilizada pelos chineses foi um ponto de partida inadequado.
"Esta (a urina) é provavelmente uma das piores fontes, pois existem muito poucas células desde o início (do processo) e a eficiência de transformá-las em células-tronco é muito baixa", rebate Mason.
"Você simplesmente não faria (a pesquisa) dessa forma", reforça o pesquisador da UCL.
O cientista também alertou sobre os riscos de contaminação, como aquela causada por bactérias, que seriam bem maiores se comparados ao uso de outros tipos de células.
"O grande desafio aqui é que o dente tenha polpa com nervos e vasos sanguíneos que temos que ter certeza que se integrariam para se transformarem num dente permanente".
James Gallagher
Repórter de Ciência e Saúde da BBC News
Veja a matéria completa aqui.
Japão autoriza primeiros testes clínicos com células-tronco pluripotentes induzidas - Revista Veja - 19/07/2013
Pesquisadores poderão testar terapia que usa iPSCs para tratar deterioração da retina em pacientes humanos.
O Ministério da Saúde do Japão anunciou nesta sexta-feira a autorização para os primeiros testes clínicos utilizando células-tronco pluripotentes induzidas (iPSCs). É a primeira vez em todo o mundo que esse tipo de estudo é liberado em seres humanos.
As iPSCs são criadas a partir de células adultas comuns, e reprogramadas geneticamente para atingir um estado semelhante ao das células-tronco embrionárias. A partir de apenas quatro alterações em seu DNA, elas se tornam capazes de se transformar em qualquer tipo de tecido do corpo humano.
Os testes liberados pelo governo japonês têm como objetivo tratar pacientes com degeneração macular, uma doença que normalmente atinge pessoas com mais de 55 anos, deteriorando sua retina e podendo levar à cegueira. Os pesquisadores japoneses propõem usar iPSCs para cultivar novas células da retina desses pacientes — livres dos danos causados pela doença — e implantá-las de volta em seus olhos.
No ano passado, o pesquisador japonês Shinya Yamanaka e o britânico John Gurdon receberam o Prêmio Nobel de Medicina por terem concebido o método que permite reprogramar células adultas para transformá-las em iPSCs, um procedimento que foi considerado chave para dar início à medicina regenerativa. A técnica, no entanto, ficou restrita aos laboratórios. Até agora, as únicas pesquisas realizadas em seres humanos haviam utilizado células-tronco embrionárias, que são menos versáteis(*) e enfrentam forte oposição de grupos religiosos.
Com o anúncio do governo japonês, os pesquisadores podem ter dado um passo decisivo para a aplicação clínica das iPSCs. “As células-tronco pluripotentes induzidas surgiram em 2006. É incrível que tão pouco tempo depois, elas já estejam prontas para serem testadas em humanos. Isso mostra o quão rápido essa área está se desenvolvendo”, diz Lygia da Veiga Pereira, geneticista e diretora do Laboratório Nacional de Células-Tronco Embrionárias da USP.
(Com Agência France-Presse)
(*) Aqui uma correção nossa sobre a matéria da Revista Veja. As células-tronco embrionárias não são menos versáteis que as células iPS. Ambas são ditas pluripotentes, ou seja, capazes de se transformar em qualquer célula do organismo adulto. Ou seja, possuem o mesmo potencial.
O Ministério da Saúde do Japão anunciou nesta sexta-feira a autorização para os primeiros testes clínicos utilizando células-tronco pluripotentes induzidas (iPSCs). É a primeira vez em todo o mundo que esse tipo de estudo é liberado em seres humanos.
As iPSCs são criadas a partir de células adultas comuns, e reprogramadas geneticamente para atingir um estado semelhante ao das células-tronco embrionárias. A partir de apenas quatro alterações em seu DNA, elas se tornam capazes de se transformar em qualquer tipo de tecido do corpo humano.
Os testes liberados pelo governo japonês têm como objetivo tratar pacientes com degeneração macular, uma doença que normalmente atinge pessoas com mais de 55 anos, deteriorando sua retina e podendo levar à cegueira. Os pesquisadores japoneses propõem usar iPSCs para cultivar novas células da retina desses pacientes — livres dos danos causados pela doença — e implantá-las de volta em seus olhos.
No ano passado, o pesquisador japonês Shinya Yamanaka e o britânico John Gurdon receberam o Prêmio Nobel de Medicina por terem concebido o método que permite reprogramar células adultas para transformá-las em iPSCs, um procedimento que foi considerado chave para dar início à medicina regenerativa. A técnica, no entanto, ficou restrita aos laboratórios. Até agora, as únicas pesquisas realizadas em seres humanos haviam utilizado células-tronco embrionárias, que são menos versáteis(*) e enfrentam forte oposição de grupos religiosos.
Com o anúncio do governo japonês, os pesquisadores podem ter dado um passo decisivo para a aplicação clínica das iPSCs. “As células-tronco pluripotentes induzidas surgiram em 2006. É incrível que tão pouco tempo depois, elas já estejam prontas para serem testadas em humanos. Isso mostra o quão rápido essa área está se desenvolvendo”, diz Lygia da Veiga Pereira, geneticista e diretora do Laboratório Nacional de Células-Tronco Embrionárias da USP.
(Com Agência France-Presse)
(*) Aqui uma correção nossa sobre a matéria da Revista Veja. As células-tronco embrionárias não são menos versáteis que as células iPS. Ambas são ditas pluripotentes, ou seja, capazes de se transformar em qualquer célula do organismo adulto. Ou seja, possuem o mesmo potencial.
Fábrica de órgãos - Ciência Hoje On line - 04/07/2013
Fígado humano funcional é criado em laboratório a partir de células-tronco, anunciam pesquisadores. Técnica pode futuramente salvar pacientes que hoje dependem de transplante.
Ainda deve levar algum tempo, mas as longas filas de espera por transplante de fígado podem estar com os dias contados. A depender da evolução da medicina regenerativa, no futuro poderá ser possível ‘fabricar’ um órgão novo, em laboratório, usando células do próprio paciente.
Um grande passo nesse sentido foi dado por pesquisadores da Universidade de Yokohama, no Japão. Em artigo que será publicado na edição desta semana da revistaNature, o grupo descreve como conseguiu produzir um fígado humano funcional a partir das chamadas células-tronco pluripotentes induzidas (iPS, na sigla em inglês).
Diferentemente da célula-tronco embrionária, a iPS é obtida por meio da reprogramação genética de uma célula adulta já diferenciada. O primeiro procedimento que o grupo japonês realizou foi direcionar a diferenciação de iPS, in vitro, produzindo células hepáticas endodérmicas (encontradas no embrião e que dão origem ao tecido do fígado).
A seguir, esse material foi cultivado com outros três tipos de células – estromáticas, mesenquimais e endoteliais da veia umbilical humana – e gerou um tipo de órgão tridimensional, embora rudimentar, chamado de broto de fígado. Confirmada a existência de uma rede vascular, o broto foi transplantado para um camundongo e amadureceu, realizando todas as funções de um fígado humano.
Experimentos anteriores com iPS falharam ao tentar produzir o órgão. “A diferença é que se buscava diferenciar células em hepatócitos [que produzem proteínas no fígado] em vez de produzir o órgão como um todo”, diz Takanori Takebe, um dos autores da pesquisa.
Aplicação clínica
Embora os testes do funcionamento do órgão tenham ocorrido em um roedor, o pesquisador afirma haver grande chance de o processo funcionar em pessoas. “Todos os tipos de células usados no estudo provêm de pacientes humanos e confirmaram funções especificamente humanas”, explica. “Assim, a aplicação clínica é altamente viável.”
Substâncias que naturalmente são metabolizadas de modo diferente por camundongos ao serem administradas ao animal com o fígado gerado em laboratório resultaram em produtos de metabolismo do órgão humano.
Takebe afirma ainda que outros órgãos provavelmente poderão ser gerados com a mesma técnica. “Ao menos os endodérmicos, como o pâncreas, que se desenvolvem a partir do mesmo folheto embrionário que o fígado”, diz.
Marco
Para o biólogo Stevens Rehen, chefe do Laboratório Nacional de Células-Tronco Embrionárias da Universidade Federal do Rio de Janeiro (UFRJ), o feito dos japoneses é um marco nos estudos da medicina regenerativa. “É a primeira vez que se consegue criar um órgão funcional a partir de células programadas”, ressalta. “O que chama a atenção é a estratégia de se criar um broto, e não o órgão todo fora do corpo.”
A equipe da Universidade de Yokohama espera que em mais sete a dez anos possa iniciar testes clínicos com humanos. “Há ainda um grande desafio que é conseguir produzir uma quantidade enorme de brotos de fígado a um custo razoável”, diz Takebe. “Considerando que o fígado tem mais de cem bilhões de hepatócitos e que as filas para transplante em países como os Estados Unidos chegam à casa dos milhares de pacientes, você pode imaginar quantos brotos precisaríamos gerar.”
Segundo a Associação Brasileira de Transplantes de Órgãos, 1.240 pessoas estão na lista de espera para receber um fígado em 13 unidades federativas do Brasil (Bahia, Ceará, Distrito Federal, Espírito Santo, Goiás, Minas Gerais, Paraná, Pernambuco, Rio de Janeiro, Rio Grande do Sul, Rondônia, Santa Catarina, São Paulo e Sergipe), sendo 683 apenas no estado de São Paulo. Os dados são de março de 2013.
Célio Yano
Ciência Hoje On-line/ PR
Veja a matéria na íntegra aqui
Ainda deve levar algum tempo, mas as longas filas de espera por transplante de fígado podem estar com os dias contados. A depender da evolução da medicina regenerativa, no futuro poderá ser possível ‘fabricar’ um órgão novo, em laboratório, usando células do próprio paciente.
Um grande passo nesse sentido foi dado por pesquisadores da Universidade de Yokohama, no Japão. Em artigo que será publicado na edição desta semana da revistaNature, o grupo descreve como conseguiu produzir um fígado humano funcional a partir das chamadas células-tronco pluripotentes induzidas (iPS, na sigla em inglês).
Diferentemente da célula-tronco embrionária, a iPS é obtida por meio da reprogramação genética de uma célula adulta já diferenciada. O primeiro procedimento que o grupo japonês realizou foi direcionar a diferenciação de iPS, in vitro, produzindo células hepáticas endodérmicas (encontradas no embrião e que dão origem ao tecido do fígado).
A seguir, esse material foi cultivado com outros três tipos de células – estromáticas, mesenquimais e endoteliais da veia umbilical humana – e gerou um tipo de órgão tridimensional, embora rudimentar, chamado de broto de fígado. Confirmada a existência de uma rede vascular, o broto foi transplantado para um camundongo e amadureceu, realizando todas as funções de um fígado humano.
Experimentos anteriores com iPS falharam ao tentar produzir o órgão. “A diferença é que se buscava diferenciar células em hepatócitos [que produzem proteínas no fígado] em vez de produzir o órgão como um todo”, diz Takanori Takebe, um dos autores da pesquisa.
Aplicação clínica
Embora os testes do funcionamento do órgão tenham ocorrido em um roedor, o pesquisador afirma haver grande chance de o processo funcionar em pessoas. “Todos os tipos de células usados no estudo provêm de pacientes humanos e confirmaram funções especificamente humanas”, explica. “Assim, a aplicação clínica é altamente viável.”
Substâncias que naturalmente são metabolizadas de modo diferente por camundongos ao serem administradas ao animal com o fígado gerado em laboratório resultaram em produtos de metabolismo do órgão humano.
Takebe afirma ainda que outros órgãos provavelmente poderão ser gerados com a mesma técnica. “Ao menos os endodérmicos, como o pâncreas, que se desenvolvem a partir do mesmo folheto embrionário que o fígado”, diz.
Marco
Para o biólogo Stevens Rehen, chefe do Laboratório Nacional de Células-Tronco Embrionárias da Universidade Federal do Rio de Janeiro (UFRJ), o feito dos japoneses é um marco nos estudos da medicina regenerativa. “É a primeira vez que se consegue criar um órgão funcional a partir de células programadas”, ressalta. “O que chama a atenção é a estratégia de se criar um broto, e não o órgão todo fora do corpo.”
A equipe da Universidade de Yokohama espera que em mais sete a dez anos possa iniciar testes clínicos com humanos. “Há ainda um grande desafio que é conseguir produzir uma quantidade enorme de brotos de fígado a um custo razoável”, diz Takebe. “Considerando que o fígado tem mais de cem bilhões de hepatócitos e que as filas para transplante em países como os Estados Unidos chegam à casa dos milhares de pacientes, você pode imaginar quantos brotos precisaríamos gerar.”
Segundo a Associação Brasileira de Transplantes de Órgãos, 1.240 pessoas estão na lista de espera para receber um fígado em 13 unidades federativas do Brasil (Bahia, Ceará, Distrito Federal, Espírito Santo, Goiás, Minas Gerais, Paraná, Pernambuco, Rio de Janeiro, Rio Grande do Sul, Rondônia, Santa Catarina, São Paulo e Sergipe), sendo 683 apenas no estado de São Paulo. Os dados são de março de 2013.
Célio Yano
Ciência Hoje On-line/ PR
Veja a matéria na íntegra aqui
Pesquisa abre caminho para nova terapia contra anemia congênita - Agência FAPESP - 08/05/2013
Imagem: UNICAMP
Por Karina Toledo
Agência FAPESP – Com auxílio da técnica de reprogramação celular premiada com o Nobel de Medicina em 2012, cientistas brasileiros e americanos conseguiram transformar células da pele de portadores de uma mutação genética causadora de anemia aplástica em células-tronco pluripotentes, semelhantes às embrionárias.
Também conhecida como aplasia de medula, essa doença potencialmente fatal é caracterizada pela produção insuficiente de glóbulos brancos, vermelhos e plaquetas. O resultado são infecções frequentes, sangramentos e anemia grave.
O objetivo dos pesquisadores é encontrar, no futuro, um meio de transformar células-tronco pluripotentes induzidas (IPS, na sigla em inglês) em células-tronco hematopoiéticas – que têm a capacidade de formar todas as células do sangue –, para então infundi-las nos pacientes e promover regeneração da medula.
Atualmente, a única opção terapêutica nos casos de anemia aplástica congênita é o transplante de medula com doador, mas apenas 25% dos afetados encontram um voluntário compatível. No Brasil, estima-se o surgimento de 400 novos casos da doença por ano.
O estudo foi realizado por pesquisadores do Centro de Terapia Celular (CTC) – um dos Centros de Pesquisa, Inovação e Difusão (CEPIDs) da FAPESP – na Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo (USP), e contou com a parceria de cientistas dos Institutos Nacionais de Saúde (NIH), dos Estados Unidos. Os resultados foram descritos na edição mais recente do The Journal of Clinical Investigation.
O método de reprogramação celular usado foi descrito em 2006 por Shinya Yamanaka, da Universidade de Kyoto, no Japão, e consiste em inserir em uma célula adulta certas proteínas que alteram a expressão do genoma celular.
“Esses quatro fatores de transcrição descobertos por Yamanaka ativam genes relacionados ao estágio embrionário da célula e desligam outros genes que deveriam estar ativos após o amadurecimento celular. Mas não sabíamos se era possível fazer essa reprogramação em portadores da mutação genética causadora de anemia aplástica”, contou Rodrigo Calado, pesquisador do CTC que coordenou a investigação.
Segundo Calado, a aplasia de medula também pode ser de origem autoimune. Nesse caso, o próprio sistema imunológico destrói as células da medula responsáveis pela produção do sangue e o tratamento é feito com medicamentos imunossupressores.
Mas, no caso dos pacientes que participaram da pesquisa, a causa da doença é um defeito no gene responsável pela síntese de uma enzima chamada telomerase, fundamental para manter a capacidade de proliferação celular.
“Nas pontas dos cromossomos existem estruturas chamadas telômeros. Eles servem para proteger o DNA, assim como o plástico presente na ponta dos cadarços. Toda vez que a célula se divide, os telômeros diminuem de tamanho, até um momento em que a célula não consegue mais se proliferar e morre ou entra em senescência (perde a capacidade de se dividir). Isso está relacionado ao processo de envelhecimento”, explicou Calado.
Mas a enzima telomerase é capaz de manter o comprimento dos telômeros intacto mesmo após a divisão celular. Por essa razão, precisa estar altamente expressa na fase embrionária e, durante toda a vida, nas células-tronco, que estão em constante divisão. Esse é o caso das células da medula óssea.
Nos pacientes com a mutação genética, como não há telomerase suficiente, as células hematopoiéticas sofrem uma espécie de envelhecimento precoce e não conseguem proliferar adequadamente. Outras partes do corpo também são afetadas e, frequentemente, essas pessoas sofrem de cirrose hepática ou fibrose pulmonar.
“Um dos nossos objetivos era justamente ver o que acontecia com os telômeros durante o processo de reprogramação celular. Teoricamente, eles deveriam ficar mais longos, já que a célula passa por uma espécie de rejuvenescimento, ou seja, volta a um estágio anterior de seu desenvolvimento”, disse Calado.
Para fazer essa verificação, os cientistas reprogramaram as células da pele de dois grupos de pacientes: portadores de anemia aplástica com a mutação genética e voluntários saudáveis que serviram de controle.
“Pudemos observar que, no grupo controle, os telômeros dobraram de tamanho após a reprogramação celular. Já nas células com o gene mutante eles continuaram praticamente iguais”, contou o pesquisador.
Outro fenômeno observado pelo grupo foi que, ao reduzir o nível de oxigênio nas estufas onde as células pluripotentes estavam armazenadas, o tamanho dos telômeros aumentou 20% nos dois grupos após um mês.
“Reduzimos a concentração de oxigênio de 21%, presente no ar ambiente, para 5%. Isso induziu a expressão de uma proteína chamada HIF, que por sua vez aumentou a síntese da telomerase. Além disso, com menos oxigênio, o DNA sofreu menos oxidação e houve menor produção de radicais livres”, contou Calado.
Quebra-cabeça
Embora o trabalho tenha levantado uma série de resultados inéditos e promissores, ainda há muitas peças do quebra-cabeça a serem encontradas antes que essa linha de pesquisa se torne uma terapia possível de ser testada em humanos.
Um dos primeiros obstáculos a serem superados é descobrir um meio de induzir a pluripotência nas células adultas sem a necessidade de usar um vírus como vetor.
“Em nossa pesquisa, assim como na de Yamanaka, introduzimos em um vírus os genes responsáveis pela expressão das quatro proteínas necessárias para reprogramar a célula. O vírus então se integra ao cromossomo e a célula passa a sintetizar esses fatores de transcrição. Alguns grupos tentaram incluir diretamente os genes nos cromossomos das células, mas o resultado não foi tão eficiente”, contou Calado.
A parte do DNA viral responsável por causar doenças é retirada antes do procedimento. Ainda assim, é consenso entre os cientistas que as células pluripotentes obtidas por essa técnica não devem ser testadas em humanos por causa do risco de induzir a formação de tumores.
“Essas células já foram testadas em animais e, em alguns casos, houve desenvolvimento de tumores. As células-tronco obtidas de embriões já foram aplicadas em humanos e também houve casos de câncer”, contou Calado.
Para minimizar esse risco, afirmou, os cientistas precisam investigar melhor os mecanismos que regulam a expressão dos genes nas células-tronco. Dessa forma, terão um controle maior sobre seu comportamento no organismo.
Outro desafio, no caso específico da anemia aplástica, é encontrar uma forma de promover a transformação das IPS em células-tronco hematopoiéticas. “Hoje conseguimos induzir apenas transformação em células do sangue já diferenciadas, como leucócitos, plaquetas e glóbulos vermelhos”, disse Calado.
O artigo Defective telomere elongation and hematopoiesis from telomerase-mutant aplastic anemia iPSCs (doi:10.1172/JCI67146) pode ser lido em www.jci.org/articles/view/67146
A matéria acima foi publicada no site da Agência FAPESP no dia 07/05/2013. Clique aqui e veja.
Agência FAPESP – Com auxílio da técnica de reprogramação celular premiada com o Nobel de Medicina em 2012, cientistas brasileiros e americanos conseguiram transformar células da pele de portadores de uma mutação genética causadora de anemia aplástica em células-tronco pluripotentes, semelhantes às embrionárias.
Também conhecida como aplasia de medula, essa doença potencialmente fatal é caracterizada pela produção insuficiente de glóbulos brancos, vermelhos e plaquetas. O resultado são infecções frequentes, sangramentos e anemia grave.
O objetivo dos pesquisadores é encontrar, no futuro, um meio de transformar células-tronco pluripotentes induzidas (IPS, na sigla em inglês) em células-tronco hematopoiéticas – que têm a capacidade de formar todas as células do sangue –, para então infundi-las nos pacientes e promover regeneração da medula.
Atualmente, a única opção terapêutica nos casos de anemia aplástica congênita é o transplante de medula com doador, mas apenas 25% dos afetados encontram um voluntário compatível. No Brasil, estima-se o surgimento de 400 novos casos da doença por ano.
O estudo foi realizado por pesquisadores do Centro de Terapia Celular (CTC) – um dos Centros de Pesquisa, Inovação e Difusão (CEPIDs) da FAPESP – na Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo (USP), e contou com a parceria de cientistas dos Institutos Nacionais de Saúde (NIH), dos Estados Unidos. Os resultados foram descritos na edição mais recente do The Journal of Clinical Investigation.
O método de reprogramação celular usado foi descrito em 2006 por Shinya Yamanaka, da Universidade de Kyoto, no Japão, e consiste em inserir em uma célula adulta certas proteínas que alteram a expressão do genoma celular.
“Esses quatro fatores de transcrição descobertos por Yamanaka ativam genes relacionados ao estágio embrionário da célula e desligam outros genes que deveriam estar ativos após o amadurecimento celular. Mas não sabíamos se era possível fazer essa reprogramação em portadores da mutação genética causadora de anemia aplástica”, contou Rodrigo Calado, pesquisador do CTC que coordenou a investigação.
Segundo Calado, a aplasia de medula também pode ser de origem autoimune. Nesse caso, o próprio sistema imunológico destrói as células da medula responsáveis pela produção do sangue e o tratamento é feito com medicamentos imunossupressores.
Mas, no caso dos pacientes que participaram da pesquisa, a causa da doença é um defeito no gene responsável pela síntese de uma enzima chamada telomerase, fundamental para manter a capacidade de proliferação celular.
“Nas pontas dos cromossomos existem estruturas chamadas telômeros. Eles servem para proteger o DNA, assim como o plástico presente na ponta dos cadarços. Toda vez que a célula se divide, os telômeros diminuem de tamanho, até um momento em que a célula não consegue mais se proliferar e morre ou entra em senescência (perde a capacidade de se dividir). Isso está relacionado ao processo de envelhecimento”, explicou Calado.
Mas a enzima telomerase é capaz de manter o comprimento dos telômeros intacto mesmo após a divisão celular. Por essa razão, precisa estar altamente expressa na fase embrionária e, durante toda a vida, nas células-tronco, que estão em constante divisão. Esse é o caso das células da medula óssea.
Nos pacientes com a mutação genética, como não há telomerase suficiente, as células hematopoiéticas sofrem uma espécie de envelhecimento precoce e não conseguem proliferar adequadamente. Outras partes do corpo também são afetadas e, frequentemente, essas pessoas sofrem de cirrose hepática ou fibrose pulmonar.
“Um dos nossos objetivos era justamente ver o que acontecia com os telômeros durante o processo de reprogramação celular. Teoricamente, eles deveriam ficar mais longos, já que a célula passa por uma espécie de rejuvenescimento, ou seja, volta a um estágio anterior de seu desenvolvimento”, disse Calado.
Para fazer essa verificação, os cientistas reprogramaram as células da pele de dois grupos de pacientes: portadores de anemia aplástica com a mutação genética e voluntários saudáveis que serviram de controle.
“Pudemos observar que, no grupo controle, os telômeros dobraram de tamanho após a reprogramação celular. Já nas células com o gene mutante eles continuaram praticamente iguais”, contou o pesquisador.
Outro fenômeno observado pelo grupo foi que, ao reduzir o nível de oxigênio nas estufas onde as células pluripotentes estavam armazenadas, o tamanho dos telômeros aumentou 20% nos dois grupos após um mês.
“Reduzimos a concentração de oxigênio de 21%, presente no ar ambiente, para 5%. Isso induziu a expressão de uma proteína chamada HIF, que por sua vez aumentou a síntese da telomerase. Além disso, com menos oxigênio, o DNA sofreu menos oxidação e houve menor produção de radicais livres”, contou Calado.
Quebra-cabeça
Embora o trabalho tenha levantado uma série de resultados inéditos e promissores, ainda há muitas peças do quebra-cabeça a serem encontradas antes que essa linha de pesquisa se torne uma terapia possível de ser testada em humanos.
Um dos primeiros obstáculos a serem superados é descobrir um meio de induzir a pluripotência nas células adultas sem a necessidade de usar um vírus como vetor.
“Em nossa pesquisa, assim como na de Yamanaka, introduzimos em um vírus os genes responsáveis pela expressão das quatro proteínas necessárias para reprogramar a célula. O vírus então se integra ao cromossomo e a célula passa a sintetizar esses fatores de transcrição. Alguns grupos tentaram incluir diretamente os genes nos cromossomos das células, mas o resultado não foi tão eficiente”, contou Calado.
A parte do DNA viral responsável por causar doenças é retirada antes do procedimento. Ainda assim, é consenso entre os cientistas que as células pluripotentes obtidas por essa técnica não devem ser testadas em humanos por causa do risco de induzir a formação de tumores.
“Essas células já foram testadas em animais e, em alguns casos, houve desenvolvimento de tumores. As células-tronco obtidas de embriões já foram aplicadas em humanos e também houve casos de câncer”, contou Calado.
Para minimizar esse risco, afirmou, os cientistas precisam investigar melhor os mecanismos que regulam a expressão dos genes nas células-tronco. Dessa forma, terão um controle maior sobre seu comportamento no organismo.
Outro desafio, no caso específico da anemia aplástica, é encontrar uma forma de promover a transformação das IPS em células-tronco hematopoiéticas. “Hoje conseguimos induzir apenas transformação em células do sangue já diferenciadas, como leucócitos, plaquetas e glóbulos vermelhos”, disse Calado.
O artigo Defective telomere elongation and hematopoiesis from telomerase-mutant aplastic anemia iPSCs (doi:10.1172/JCI67146) pode ser lido em www.jci.org/articles/view/67146
A matéria acima foi publicada no site da Agência FAPESP no dia 07/05/2013. Clique aqui e veja.
Novo teste clínico para lesões medulares - 29/04/2013
Um novo teste clínico para lesões medulares foi aprovado em janeiro deste ano pelo FDA (Food and Drug Administration), que é a agência norte-americana que regulamenta e supervisiona desde os alimentos até medicamentos que são disponibilizados à população dos EUA.
Este novo estudo é diferente do que foi iniciado pela empresa Geron em 2010 e precocemente interrompido em 2011 alegando problemas financeiros. O protocolo da Geron atenderia pacientes com lesões com até 14 dias e a ideia era restaurar a mielina (que tem função semelhante à capa de um fio condutor de eletricidade) nos neurônios ainda remanescentes.
Ele será disponibilizado pela empresa privada Neuralstem Inc. e será voltado para lesões medulares crônicas, que são aquelas ocorridas há mais de dois anos. Para este estudo, só serão aceitos pacientes com lesão torácica e completa, ou seja, que não possuem nenhuma função sensorial ou motora abaixo da lesão. A intenção deste estudo é refazer as ligações perdidas com novas células a partir de células-tronco neurais (células capazes de se transformar apenas em células do sistema nervoso).
O estudo é de fase I, portanto, o número inicial de pacientes deverá ser reduzido, pois trata-se de uma etapa na qual se avalia a segurança do procedimento.
Quatro diferentes instituições participarão do estudo, todas nos EUA. No link abaixo é possível ver os detalhes do procedimento além dos critérios de inclusão e exclusão.
É importante ressaltar que ainda não estão recrutando candidatos e que todo procedimento como este deve ser gratuito, pois mesmo sendo oferecido por uma empresa privada, trata-se de um teste. Para maiores informações, leia o manual do paciente no site da Rede Nacional de Terapia Celular (RNTC).
Veja os detalhes do estudo clínico aqui.
Daniel Cadilhe
Stevens Rehen é o novo coordenador da RNTC - 28/03/2013
Stevens Rehen, Professor titular do Instituto de Ciências Biomédicas da UFRJ, é o novo coordenador da Rede Nacional de Terapia Celular (RNTC) que é composta por 8 Centros de Tecnologia Celular (CTCs) e 52 laboratórios.
Stevens substitui Antônio Carlos Campos de Carvalho que assume a secretaria do DECIT no Ministério da Saúde.
Stevens substitui Antônio Carlos Campos de Carvalho que assume a secretaria do DECIT no Ministério da Saúde.
Consulta Pública: Diretrizes de Exame de Pedidos de Patente na Área de Biotecnologia - 18/01/2013
Em novembro de 2012, o INPI (Instituto Nacional da Propriedade Industrial) publicou um documento contendo diretrizes de exame de pedidos de patente na área de biotecnologia.
Com o avanço cada vez maior da área de biotecnologia é natural que surjam descobertas e que os pesquisadores desejem patenteá-las. Esta é uma prática muito comum em outros países, especialmente do primeiro mundo, mas ainda muito incipiente no Brasil. Isto faz com que tenhamos que pagar caro por tecnologias porque estas foram patenteadas por seus inventores. A partir do momento que forem desenvolvidas e patenteadas no Brasil, os custos serão reduzidos e o acesso à tecnologia facilitado.
Nos últimos anos o Governo Federal tem incentivado cada vez mais a produção de patentes pelas instituições de pesquisa do país, mas de acordo com a Lei de Propriedade Intelectual (LPI), células obtidas diretamente de um animal ou com alguma modificação gênica, não são patenteáveis. Entretanto, os processos de obtenção de célula-tronco e aplicação das mesmas podem ser considerados patenteáveis desde que não impliquem ou incluam um método terapêutico e/ou cirúrgico (art. 10 (VIII)), e desde que não incidam nas disposições do art. 18(I) da LPI.
Neste documento há uma série de explicações sobre o que é ou não patenteável e procura orientar os pesquisadores a este respeito. O trecho a seguir introduz o documento: Esse texto será parte integrante da Diretriz Geral de Exame de Pedidos de Patentes e tem como objetivo definir o entendimento atual deste INPI na área de Biotecnologia. Os demais tópicos inerentes ao exame serão elencados e discutidos na referida Diretriz Geral.
Contudo, como poderão ver abaixo, o texto dedicado às células-tronco e seu processo de obtenção é extremamente reduzido e carece de maiores informações. Desta forma, é muito importante que a comunidade científica que trabalha com células-tronco discuta e opine acerca do assunto para evitar futuros entraves e para que haja maior esclarecimento sobre o que pode ser realmente patenteado.
Veja abaixo o trecho retirado do documento.
7.1.1 Células-Tronco e processo de obtenção
As células-tronco são células indiferenciadas (totipotentes, pluripotentes, ou progenitoras) que podem ser estimuladas para se diferenciarem nos tecidos que compõem o corpo humano. As células-tronco podem ser classificadas em células embrionárias ou células adultas, as primeiras apresentando grandes vantagens em função de sua capacidade de diferenciação em maior número de tecidos e facilidade de expansão. As fontes de células-tronco mais utilizadas hoje no mundo são os embriões recém-fecundados (blastocistos), criados por fertilização in vitro e que seriam descartados; os embriões criados por clonagem; as células germinativas ou órgãos de fetos abortados; o sangue retirado do cordão umbilical no momento do nascimento; alguns tecidos adultos, como a medula óssea; o tecido adiposo retirado de lipoaspiração, e até mesmo o fluido menstrual. Outra forma de obtenção de células-tronco é a partir de células maduras de tecido adulto que podem ser reprogramadas para se comportarem como células-tronco via técnicas de transferência nuclear, por alteração genética direta e também interferindo no epigenoma. De acordo com a LPI, as células propriamente ditas obtidas diretamente de um animal ou com alguma modificação gênica, não são patenteáveis diante do disposto no art. 10 (IX) ou 18(III), respectivamente. Entretanto, os processos de obtenção de célula-tronco e aplicação das mesmas podem ser considerados patenteáveis desde que não impliquem ou incluam um método terapêutico e/ou cirúrgico (art. 10 (VIII)), e desde que não incidam nas disposições do art. 18(I) da LPI.
No anexo abaixo é possível fazer o download de todo o documento.
| diretriz_biotecnologia_consulta_publica_30-11-12.pdf | |
| File Size: | 297 kb |
| File Type: | |
Pesquisa Rio - FAPERJ - Dezembro de 2012
Stevens Rehen, da RNTC e do LaNCE-UFRJ e Renata Maciel, também do LaNCE, destacam que a Medicina Regenerativa e os estudos com células-tronco já são uma realidade e prometem impactar diferentes áreas da saúde.
Acessem o link e leiam a reportagem nas páginas 27 a 29.
http://t.co/KfZv5PzX
Acessem o link e leiam a reportagem nas páginas 27 a 29.
http://t.co/KfZv5PzX
Stem Cell Action: Final Victory for Patients and Scientists in Sherley v. Sebelius
Dear Colleague,
Today has been an exciting day in the fight to protect stem cell research. I issued a statement, as spokesperson for the Stem Cell Action Coalition and Executive Director of the Genetics Policy Institute (GPI), that I would like to share with you:
“The U.S. Supreme Court denied today the plaintiffs’ application to appeal the decision of the D.C. Court of Appeals, thereby ending Sherley v Sebelius in favor of the government and upholding federal funding for human embryonic stem cell research. This is a major victory for scientifically and ethically responsible innovative research. With the cloud of this case lifted, researchers can now rest assured that the challenge to the NIH's 2009 guidelines for funding for embryonic stem cell research is over. Patients and their advocates can rejoice that this potentially lifesaving research can proceed at the federal level. But at the same time we must remain vigilant against threats at state and other policy-making levels. GPI filed amicus briefs in the United States District Court and in the Court of Appeals supporting the government’s position. We are pleased to have made a contribution to the successful outcome of the case and are grateful to GPI's counsel, Neal Goldfarb of the law firm of Butzel Long Tighe Patton, PLLC in Washington, D.C. for his extraordinary contribution to the cause,” said Bernard Siegel, Executive Director of GPI.
To read more about this development, there are news articles covering the story including CNN.com, LATimes.com and Reuters.com.
We need your help to strengthen the Pro-Cures movement and advance stem cell research and regenerative medicine. What do you think about today's announcement? Comment on our Facebook page, or reply to @StemCellAction on Twitter. We will advance stem cell research together!
Cordially,
Bernard Siegel, JD
Editor, Stem Cell Action Newsletter
Executive Director, Genetics Policy Institute
Para saber mais, clique aqui.
Edital do CNPq financia parceria entre Brasil e Cuba para pesquisas em Doença Arterial Periférica.
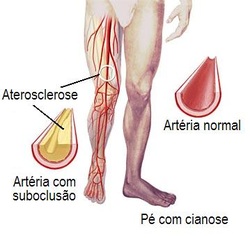
O CNPq abre edital para colaboração entre Brasil e Cuba para pesquisas em Terapia Celular para Doença Arterial Periférica.
A doença arterial periférica é uma condição dos vasos sanguíneos que leva ao estreitamento e endurecimento das artérias das pernas e dos pés. O estreitamento dos vasos sanguíneos ocasiona redução no fluxo sanguíneo, o que pode lesar nervos e outros tecidos.
A doença arterial periférica é um distúrbio comum que geralmente afeta homens com mais de 50 anos. As pessoas têm mais risco se elas tiverem um histórico de:
Colesterol anormal, Diabetes, Doença cardíaca (doença arterial coronária), Pressão arterial alta (hipertensão), Doença renal que envolve hemodiálise, Fumo, Derrame (doença cerebrovascular).
Os pesquisadores cubanos que irão participar do projeto são:
- Dr. Heriberto Artaza Sanz, Hospital Nacional Enrique Cabrera, La Habana.
- Dr. Antonio Jesús Díaz Díaz, Hospital Provincial Abel Santamaría Cuadrado, Pinar del Río.
- Dra. Norma Fernández Delgado, Instituto de Hematología e Inmunología (IHI)
- Dr. Porfirio Hernández Ramírez. Instituto de Hematología e Inmunología - [email protected] ,[email protected]
Os pesquisadores brasileiros que serão parceiros nesta pesquisa ainda serão definidos pelo CNPq através de um edital de financiamento.
Terapia celular para diabetes tipo 1 avança - Agência FAPESP - 15/10/2012
Agência FAPESP – Duas pesquisas em andamento na Universidade de São Paulo (USP) avançam o uso da terapia celular, com diferentes abordagens, para o tratamento do diabetes tipo 1 – também conhecido como diabetes infanto-juvenil ou insulinodependente.
Os resultados mais recentes das investigações foram apresentados durante o 7º Congresso Brasileiro de Células-Tronco e Terapia Celular, realizado em São Paulo no início de outubro, com apoio da FAPESP.
No Centro de Terapia Celular (CTC) – um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP na Faculdade de Medicina de Ribeirão Preto (FMRP-USP) – a estratégia é interromper o processo de destruição do pâncreas que ocorre em portadores de diabetes tipo 1 por meio de um transplante de células-tronco hematopoiéticas retiradas da medula óssea do próprio paciente.
A técnica foi idealizada pelo imunologista Julio Voltarelli, que morreu em março de 2012. A pesquisa continua sob a coordenação de Maria Carolina de Oliveira Rodrigues e Belinda Pinto Simões. Também colabora o endocrinologista Carlos Eduardo Couri.
“Diabetes tipo 1 é uma doença autoimune: o próprio sistema imunológico do paciente ataca as células produtoras de insulina no pâncreas. Quando os sintomas começam a aparecer, é sinal que aproximadamente 80% das células já foram danificadas”, explicou Rodrigues.
Se o processo de destruição for interrompido nesse ponto e as células restantes forem preservadas, segundo a pesquisadora, é possível que o paciente consiga se livrar da dependência de insulina ou pelo menos diminuir as doses.
“Não falamos em cura, mas em facilitar o controle da doença e evitar complicações crônicas do diabetes, como retinopatia, nefropatia e neuropatia”, disse Rodrigues.
Com esse objetivo, foi iniciado em 2004 um primeiro protocolo experimental com 25 pacientes. Eles passaram por um procedimento para coletar e isolar células-tronco hematopoiéticas da medula óssea, que foram congeladas. Em seguida, foram submetidos a uma quimioterapia agressiva para destruir o que restava da medula e de todas as células do sangue (leia reportagem).
“O objetivo é zerar o sistema imunológico, fazendo com que ele pare de agredir o pâncreas. Em seguida, infundimos as células-tronco congeladas para que elas produzam uma nova medula e novas células sanguíneas”, disse Rodrigues.
De acordo com dados apresentados pela pesquisadora durante o congresso, três dos 25 pacientes permanecem até hoje livres de insulina. Outros 18 tiveram de voltar a tomar o hormônio após um período que variou entre seis meses e cinco anos, mas recebem atualmente doses menores do que antes do tratamento.
Outros quatro pacientes não conseguiram se livrar da insulina e nem reduzir a dose. “Três deles tinham histórico de cetoacidose, uma complicação comum em pacientes com estágio avançado da doença. Provavelmente, esses voluntários que não reagiram ao tratamento já não tinham mais células produtoras de insulina para serem salvas”, contou Rodrigues.
Com base nos dados preliminares do primeiro experimento, a equipe iniciou um novo protocolo em 2010. “As análises indicaram que a quimioterapia não foi forte o suficiente para destruir todas as células sanguíneas em alguns pacientes, então estamos testando um tratamento ainda mais agressivo”, disse.
Até o momento, apenas dois voluntários foram submetidos à quimioterapia e ao transplante. A equipe aceita inscrições ([email protected]) de novos candidatos maiores de 18 anos e diagnosticados há menos de cinco meses.
Paralelamente, em outro protocolo experimental iniciado em 2008, os pesquisadores do CTC tentaram modular o sistema imunológico de oito pacientes diabéticos por meio de aplicações de células mesenquimais.
“Essas células estão presentes em praticamente todos os órgãos do corpo humano e auxiliam no suporte dos tecidos, ajudam na nutrição e produzem fatores de crescimento. Nós as retiramos da medula óssea apenas para facilitar a coleta”, disse Rodrigues.
Nesse caso, as células mesenquimais são retiradas de um parente do paciente diabético. A expectativa dos cientistas é que elas consigam combater a inflamação no pâncreas e ajudar na regeneração do órgão.
“Existe ainda uma terceira hipótese, menos provável, de que as células mesenquimais seriam capazes de migrar e de se diferenciar em células do pâncreas produtoras de insulina. Isso ainda precisa ser estudado”, disse.
A resposta, no entanto, não foi animadora nos primeiros pacientes tratados e a equipe pretende iniciar um novo experimento em 2013. “A ideia é aplicar quantidades maiores de células mesenquimais. Como é um tratamento de baixa toxicidade e não envolve quimioterapia, poderemos testar em pacientes entre 5 e 35 anos”, disse Rodrigues.
Cápsula protetora
No Núcleo de Terapia Celular e Molecular (Nucel), coordenado pela professora Mari Cleide Sogayar e vinculado ao Instituto de Química e à Faculdade de Medicina da USP, a estratégia é encapsular as ilhotas pancreáticas – conjuntos de células produtoras de insulina – com um material biocompatível capaz de evitar a rejeição após ser aplicado no organismo do diabético.
“O método tem funcionado muito bem nos testes com animais. Implantamos ilhotas de ratos em camundongos para provar que a cápsula é mesmo capaz de evitar a destruição das células pelo sistema imunológico”, disse Sogayar.
As cápsulas contendo ilhotas de rato são implantadas no peritônio, membrana que reveste a parte interna da cavidade abdominal e recobre órgãos como o estômago e intestino. “Evitamos mexer com o pâncreas, pois ele é muito sensível e se inflama com facilidade. As ilhotas passam a produzir insulina em outra região”, explicou.
Após o tratamento, os camundongos diabéticos livraram-se completamente da insulina, segundo Sogayar. “Depois de 250 dias, retiramos as cápsulas dos animais por meio de uma lavagem do peritônio e conseguimos mostrar que as ilhotas estavam intactas. Os camundongos, por outro lado, voltaram a ficar diabéticos”, disse.
Como um camundongo vive aproximadamente um ano, é possível afirmar que o tratamento mostrou eficácia por quase toda a vida do roedor. “Mas em humanos, se for necessário, as cápsulas podem ser substituídas depois de algum tempo”, disse a pesquisadora.
Para facilitar esse procedimento, a equipe do Nucel trabalha, em colaboração com a empresa CellProtect (spin-off do Nucel), no desenvolvimento de um dispositivo, provavelmente subcutâneo, que armazenaria as cápsulas com as ilhotas e funcionaria como um pâncreas artificial.
“Um tubo ficaria para fora da pele e facilitaria a substituição das cápsulas, quando necessário. Mas primeiro precisamos descobrir como manter a irrigação sanguínea no local. Uma possibilidade seria usar fatores peptídicos como o VEGF (vascular endothelial growth factor) recombinante, que já é produzido pelo Nucel”, disse Sogayar.
Embora a ideia de encapsular as ilhotas tenha sido desenvolvida em pesquisas internacionais, a equipe coordenada por Sogayar conseguiu aperfeiçoar o método e criou um novo material biocompatível contendo uma proteína chamada laminina, que foi patenteado com o nome de Bioprotect. Parte da pesquisa contou com financiamento da FAPESP.
“A grande vantagem em relação ao transplante de ilhotas, feito com células de um doador humano cadáver para o paciente diabético tipo 1, é que as cápsulas dispensam o uso de drogas imunossupressoras, que possuem efeitos colaterais importantes. Além disso, há poucos doadores de órgãos”, disse Sogayar.
“No futuro, acrescentou, a ideia é transplantar cápsulas contendo células-tronco diferenciadas em células produtoras de insulina ou, até mesmo, ilhotas de porcos em humanos”, disse Sogayar.
Por Karina Toledo
Veja a matéria no site da Agência FAPESP
Células-tronco neurais podem tratar doença degenerativa rara - Veja - 11/10/2012
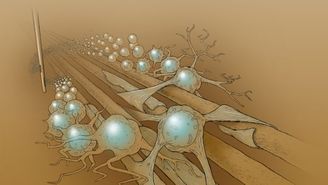
Nos Estados Unidos, pesquisadores apresentaram os resultados de um ano de tratamento em crianças com Palizaeus-Marzbacher, enfermidade que reduz a produção de mielina no cérebro. Transplante não apresentou rejeição e indicou 'modestos avanços' nas habilidades motoras dos pacientes.
Pela primeira vez, um tratamento com células-tronco neurais conseguiu aumentar a produção de mielina em crianças que sofrem de Pelizaeus-Marzbacher (PMD, na sigla em inglês), uma doença degenerativa bastante rara. O resultado do transplante – e de um acompanhamento médico que durou um ano – foi publicado nesta quarta-feira no periódico Science Translational Medicine e pode ser um primeiro passo para o desenvolvimento de terapias para a falta de mielina no sistema nervoso.
A pesquisa é um marco histórico na área. "Antes deste trabalho, não havia evidências de que células-tronco neurais eram capazes de incorporar e funcionar normalmente no cérebro", afirmou ao site de VEJA Nalin Gupta (leia a entrevista abaixo), chefe de cirurgia neurológica do departamento de pediatria do Benioff Children’s Hospital, da Universidade da Califórnia, e um dos autores do artigo.
A mielina envolve as fibras nervosas com a função de acelerar os impulsos nervosos. Dessa forma, uma disfunção na produção de mielina faz com que os impulsos não sejam transmitidos de forma adequada e debilita as funções neurológicas. As pessoas que nascem como Palizaeus-Marzbacher, cuja transmissão é genética, não conseguem andar ou falar e normalmente enfrentam problemas respiratórios; a degeneração do sistema nervoso leva à morte entre os 10 e 15 anos de idade.
Uma equipe do Benioff Children’s Hospital, da Universidade da Califórnia, em San Francisco, transplantou em 2011 células-troncos neurais desenvolvidas pela empresa norte-americana StemCells, patrocinadora do projeto, no cérebro de quatro crianças diagnosticadas com essa doença neurodegenerativa. Por meio de ressonâncias magnéticas realizadas ao longo de um ano, a equipe médica encontrou sinais de que as células implantadas (HuCNS-SC, derivadas do cérebro de fetos) estavam recebendo sangue e nutrientes dos tecidos neurais. Além do mais, os pesquisadores encontraram evidências indiretas de que as HuCNS-SC se tornaram oligodendrócitos, justamente as células responsáveis pela produção de mielina. David H. Rowitch, chefe de neonatologia no Benioff, comparou o processo a "uma planta criando raízes."
"A pesquisa nos dá uma importante prova para o princípio que aprova o uso de células-tronco no tratamento de um amplo espectro de doenças relacionadas à falta de mielina, como esclerose múltipla, paralisia cerebral e lesões na medula espinhal", afirma ao site de VEJA a StemCells. Caso esse primeiro passo no futuro de fato resulte num tratamento viável, o número de possíveis beneficiados é expressivo. Cerca de 400.000 pessoas têm esclerose múltipla e outras 764.000 têm paralisia cerebral, só nos Estados Unidos. Apesar dos tratamentos que diminuem a progressão da esclerose múltipla e da paralisia cerebral, não existe cura para estas enfermidades.
Os testes realizados 12 meses após o transplante revelaram que três das quatro crianças, que têm entre seis meses e cinco anos de idade, apresentaram "avanços modestos" em funções motoras e mentais em comparação com os exames anteriores ao transplante. Uma delas, por exemplo, consegue agora dar alguns passos, com ajuda de um adulto. Outra se alimentou oralmente, pela primeira vez, com comida sólida.
Cautela – O estudo alerta que os benefícios clínicos não podem ser necessariamente atribuídos à intervenção, já que esta envolveu um reduzido número de participantes e não teve um grupo de controle. "Mesmo assim, é um primeiro passo importante, que traz a esperança de que o transplante de células HuCNS-SC possa ser capaz de atuar na patologia fundamental no cérebro de pacientes com Palizaeus-Marzbacher", afirma Nalin Gupta, do Benioff Children’s Hospital.
Se não pode ter seu efeito clínico comprovado, a equipe do Benioff e da StemCells acredita ter demonstrado que o transplante da célula HuCNS-SC é seguro. Isso porque, um ano após a cirurgia, não há qualquer sinal de rejeição. "Esse ponto é bastante significante porque as células não pertenciam aos pacientes", diz David Rowitch. Nalin Gupta, por sua vez, explica que as crianças receberam um medicamento, por diversos meses, que é utilizado para prevenir rejeições em pacientes que recebem transplante de órgãos sólidos.
Na opinião da professora Lygia da Veiga Pereira, chefe do Laboratório Nacional de Células-Tronco Embrionárias da Universidade de São Paulo (LaNCE-USP), a comprovação da segurança do procedimento pode abrir as portas para outras investigações. "Num ensaio clínico, a primeira coisa que você precisa mostrar é segurança. Isso pode acelerar a aprovação, pelos órgãos reguladores, de testes em outras doenças, como lesão de medula."
Camundongos – Também nesta quarta-feira, uma pesquisa complementar realizada pela StemCells — e também publicada na Science Translational Medicine – reforça a tese do alto potencial de mielinização da célula HuCNS-SC no sistema nervoso. As mesmas células-tronco neurais foram implantadas em um tipo de camundongo incapaz de produzir um componente-chave da mielina. "Técnicas de análise sofisticadas foram usadas para confirmar que as alterações observadas pelas imagens de ressonância magnética derivavam da mielina humana gerada pelas células transplantadas", diz a empresa. "Os resultados demonstrados no trabalho de Uchido (Nobuko Uchida, pesquisadora vice-presidente da StemCells Biology e a cargo dos testes nos camundongos) confirmam que a as células-tronco humanas transplantadas não só sobreviveram como produziram mielina. É possível que algo muito semelhante ocorra no cérebro humano", afirma Nalin Gupta.
Pela primeira vez, um tratamento com células-tronco neurais conseguiu aumentar a produção de mielina em crianças que sofrem de Pelizaeus-Marzbacher (PMD, na sigla em inglês), uma doença degenerativa bastante rara. O resultado do transplante – e de um acompanhamento médico que durou um ano – foi publicado nesta quarta-feira no periódico Science Translational Medicine e pode ser um primeiro passo para o desenvolvimento de terapias para a falta de mielina no sistema nervoso.
A pesquisa é um marco histórico na área. "Antes deste trabalho, não havia evidências de que células-tronco neurais eram capazes de incorporar e funcionar normalmente no cérebro", afirmou ao site de VEJA Nalin Gupta (leia a entrevista abaixo), chefe de cirurgia neurológica do departamento de pediatria do Benioff Children’s Hospital, da Universidade da Califórnia, e um dos autores do artigo.
A mielina envolve as fibras nervosas com a função de acelerar os impulsos nervosos. Dessa forma, uma disfunção na produção de mielina faz com que os impulsos não sejam transmitidos de forma adequada e debilita as funções neurológicas. As pessoas que nascem como Palizaeus-Marzbacher, cuja transmissão é genética, não conseguem andar ou falar e normalmente enfrentam problemas respiratórios; a degeneração do sistema nervoso leva à morte entre os 10 e 15 anos de idade.
Uma equipe do Benioff Children’s Hospital, da Universidade da Califórnia, em San Francisco, transplantou em 2011 células-troncos neurais desenvolvidas pela empresa norte-americana StemCells, patrocinadora do projeto, no cérebro de quatro crianças diagnosticadas com essa doença neurodegenerativa. Por meio de ressonâncias magnéticas realizadas ao longo de um ano, a equipe médica encontrou sinais de que as células implantadas (HuCNS-SC, derivadas do cérebro de fetos) estavam recebendo sangue e nutrientes dos tecidos neurais. Além do mais, os pesquisadores encontraram evidências indiretas de que as HuCNS-SC se tornaram oligodendrócitos, justamente as células responsáveis pela produção de mielina. David H. Rowitch, chefe de neonatologia no Benioff, comparou o processo a "uma planta criando raízes."
"A pesquisa nos dá uma importante prova para o princípio que aprova o uso de células-tronco no tratamento de um amplo espectro de doenças relacionadas à falta de mielina, como esclerose múltipla, paralisia cerebral e lesões na medula espinhal", afirma ao site de VEJA a StemCells. Caso esse primeiro passo no futuro de fato resulte num tratamento viável, o número de possíveis beneficiados é expressivo. Cerca de 400.000 pessoas têm esclerose múltipla e outras 764.000 têm paralisia cerebral, só nos Estados Unidos. Apesar dos tratamentos que diminuem a progressão da esclerose múltipla e da paralisia cerebral, não existe cura para estas enfermidades.
Os testes realizados 12 meses após o transplante revelaram que três das quatro crianças, que têm entre seis meses e cinco anos de idade, apresentaram "avanços modestos" em funções motoras e mentais em comparação com os exames anteriores ao transplante. Uma delas, por exemplo, consegue agora dar alguns passos, com ajuda de um adulto. Outra se alimentou oralmente, pela primeira vez, com comida sólida.
Cautela – O estudo alerta que os benefícios clínicos não podem ser necessariamente atribuídos à intervenção, já que esta envolveu um reduzido número de participantes e não teve um grupo de controle. "Mesmo assim, é um primeiro passo importante, que traz a esperança de que o transplante de células HuCNS-SC possa ser capaz de atuar na patologia fundamental no cérebro de pacientes com Palizaeus-Marzbacher", afirma Nalin Gupta, do Benioff Children’s Hospital.
Se não pode ter seu efeito clínico comprovado, a equipe do Benioff e da StemCells acredita ter demonstrado que o transplante da célula HuCNS-SC é seguro. Isso porque, um ano após a cirurgia, não há qualquer sinal de rejeição. "Esse ponto é bastante significante porque as células não pertenciam aos pacientes", diz David Rowitch. Nalin Gupta, por sua vez, explica que as crianças receberam um medicamento, por diversos meses, que é utilizado para prevenir rejeições em pacientes que recebem transplante de órgãos sólidos.
Na opinião da professora Lygia da Veiga Pereira, chefe do Laboratório Nacional de Células-Tronco Embrionárias da Universidade de São Paulo (LaNCE-USP), a comprovação da segurança do procedimento pode abrir as portas para outras investigações. "Num ensaio clínico, a primeira coisa que você precisa mostrar é segurança. Isso pode acelerar a aprovação, pelos órgãos reguladores, de testes em outras doenças, como lesão de medula."
Camundongos – Também nesta quarta-feira, uma pesquisa complementar realizada pela StemCells — e também publicada na Science Translational Medicine – reforça a tese do alto potencial de mielinização da célula HuCNS-SC no sistema nervoso. As mesmas células-tronco neurais foram implantadas em um tipo de camundongo incapaz de produzir um componente-chave da mielina. "Técnicas de análise sofisticadas foram usadas para confirmar que as alterações observadas pelas imagens de ressonância magnética derivavam da mielina humana gerada pelas células transplantadas", diz a empresa. "Os resultados demonstrados no trabalho de Uchido (Nobuko Uchida, pesquisadora vice-presidente da StemCells Biology e a cargo dos testes nos camundongos) confirmam que a as células-tronco humanas transplantadas não só sobreviveram como produziram mielina. É possível que algo muito semelhante ocorra no cérebro humano", afirma Nalin Gupta.
"Não havia evidências de que células-tronco neurais eram capazes de incorporar e funcionar normalmente no cérebro"

Dr. Nalin Gupta
Chefe de cirurgia neurológica do departamento de pediatria do Benioff Children’s Hospital e um dos autores do artigo Neural Stem Cell Engraftment and Myelination in the Human Brain
Como o senhor resumiria a contribuição que esse trabalho traz para o estudo de células-tronco?
Antes deste trabalho, não havia evidências de que células-tronco neurais eram capazes de se incorporar e funcionar normalmente no cérebro.
O que indica que as células-tronco transplantadas estão produzindo mielina?
Como os pacientes com Pelizaeus-Marzbacher não têm o isolamento normal (mielina) ao redor das fibras nervosas do cérebro (axônios), nós pudemos explorar o fato de que algumas técnicas de ressonância magnética são muito sensíveis a mudanças que ocorrem quando os axônios são mielinizados. Isto (mielinização) é comum no desenvolvimento normal durante os primeiros anos de vida, mas não é algo que esperamos de pacientes com a doença Pelizaeus-Marzbacher. As informações da ressonância magnética, que são consistentes com mielinização, sugerem, portanto, que as células transplantadas estão causando as mudanças.
O estudo poderia ser um primeiro passo para o tratamento da doença de Pelizaeus-Marzbacher – ou outras doenças causadas pela falta de mielina?
Ainda há muitas questões sobre a efetividade desse tipo de tratamento. Certamente o objetivo de longo prazo para terapia com células-tronco é tratar casos como esclerose múltipla ou Alzheimer, mas tal possibilidade é para o futuro. Os resultados deste estudo certamente apoiam a realização de novas pesquisas para analisar o uso dessas células em grupos maiores de pacientes, para ver se conseguimos confirmar e expandir os atuais resultados.
Quais foram os “avanços modestos em funções neurológicas” observadas nas crianças que receberam o transplante?
Todos os quatro pacientes têm a doença Pelizaeus-Marzbacher, que provoca a perda de funções com o tempo. O nosso trabalho descreve como alguns desses pacientes apresentaram avanços um ano após o transplante. Os avanços incluem um melhor suporte do tronco ou a respiração sem a ajuda de um respirador. Um paciente conseguiu dar alguns passos.
É importante ressaltar, no entanto, que qualquer resultado não pode ser necessariamente atribuído ao transplante. Isso porque o teste envolveu um número reduzido de pacientes e não houve um grupo de controle (pessoas com a mesma doença, mas não submetidas ao tratamento, para efeitos de comparação). Um outro estudo para testar a eficácia deveria ser conduzido.
Qual a relação do seu trabalho com o artigo da doutora Nobuko Uchida, que testou a célula-tronco HuCNS-SC em camundongos?
Os dois estudos se complementam porque as mesmas células usadas no tratamento com humanos foram transplantadas em camundongos com um distúrbio de mielina semelhante. Como podemos estudar as mudanças que as células causam, com muito detalhe, em camundongos, os resultados demonstrados no trabalho de Uchido confirmam que a as células-tronco humanas transplantadas não só sobreviveram, como produziram mielina. É possível que algo muito semelhante ocorra no cérebro humano.
Clique aqui e leia a matéria do site da Veja.
Britânico e japonês ganham prêmio Nobel de Medicina - O Globo - 08/10/2012

ESTOCOLMO - Os cientistas que renovaram a pesquisa de células-tronco e abriram caminho para uma revolução na engenharia de tecidos são os ganhadores do Prêmio Nobel de Medicina de 2012, anunciado esta manhã, pelo Instituto Karolinska, na Suécia. Os nomes do britânico John Gurdon e do japonês Shinya Yamanaka estavam entre os favoritos para receber o prêmio. Gurdon por ter feito nos anos 60 as descobertas fundamentais que levaram Yamanaka, décadas depois, a encontrar um caminho para obter uma nova fonte de células-tronco, quase tão versáteis quanto as embrionárias.
Yamanaka é um dos especialistas em engenharia de tecidos mais conhecidos do mundo. O instituto que concede o Nobel de Medicina informou em nota que os dois foram premiados por terem descoberto que células-maduras e especializadas podem ser reprogramadas para se transformar em células imaturas capazes de se desenvolverem em todos os tecidos do corpo. “Suas descobertas revolucionaram nosso conhecimento de como as células se organizam e se desenvolvem”, disse a nota do Karolinska.
Diferentemente de várias outras descobertas laureadas com o mais importante prêmio da medicina, os trabalhos de Gurdon e Yamanaka têm aplicação direta no desenvolvimento de novas terapias celulares. Em 1962, John B. Gurdon rompeu um paradigma da ciência ao mostrar que a especialização das células é reversível. Numa experiência hoje clássica e na época herética, ele substituiu as células imaturas do núcleo de um óvulo de um sapo pelo núcleo de uma célula intestinal madura. Com isso, ele modificou o óvulo que se desenvolveu como um girino.
Gurdon provou que o DNA da célula madura ainda tinha toda a informação necessária para desenvolver todas os tipos de células que formam um sapo. Quatro décadas depois, Yamanaka descobriu como fazer para que células adultas de camundongos fossem reprogramadas em células-tronco imaturas. Realizada em 2006, a descoberta teve imenso impacto na altamente competitiva pesquisa de células-tronco. Na semana passada, por exemplo, estudos do próprio Yamanaka e colegas na “Science” mostraram ser possível usar células reprogramadas para criar óvulos de camundongos que puderam ser fertilizados e gerar filhotes normais, numa pesquisa que abriu caminho para combater a infertilidade.
Na pesquisa premiada com o Nobel, Yamanaka descobriu que a introdução de alguns poucos genes pode reprogramar célula adultas ao estágio de células-tronco pluripotentes, capazes de originar numerosos tecidos do corpo. As chamadas células-tronco de reprogramação induzida são vistas como uma das mais acessíveis e promissoras fontes de células para a engenharia de tecidos, área que acena com a possibilidade de tratamentos para problemas tão diversos quanto infarto e mal de Parkinson.
O trabalho dos dois pesquisadores revelou ao mundo que as células são muito mais flexíveis do que jamais poderia se imaginar. Elas não estão confinadas para sempre num estágio especializado. Para as células, rejuvenescer totalmente, da maturidade ao estágio de embrião é possível. O segredo está nos genes que apagam a memória da especialização e as faz de novo flexíveis como as de um embrião. Gurdon e Yamanaka mudaram os livros de medicina e reescreveram a ciência.
John Gurdon trabalha no instituto que leva o seu nome em Cambridge, Inglaterra. Ele tem 79 anos. Shinya Yamanaka tem 50 anos e trabalha na Universidade de Kioto, no Japão.
Clique aqui e veja a matéria no site de O Globo.
Acesse também a página do Prêmio Nobel.
'Ciência sem Fronteiras’ – importações ainda são um impasse - Veja - 01/08/2012
Essa iniciativa que tem merecido destaque da imprensa e apoio da presidente Dilma foi aplaudida por todos os cientistas e por aqueles que acreditam que o desenvolvimento de um país passa pela ciência e tecnologia. A ciência não possui fronteiras. Ela é universal. O programa “Ciência sem Fronteiras” prevê a ida de 100.000 estudantes brasileiros para universidades do exterior nos próximos anos. A expectativa é que ao voltarem, eles tragam na bagagem novas tecnologias, novas maneiras de pesquisar e impulsionar a ciência e o estabelecimento de intercâmbio científico com laboratórios internacionais. Do mesmo modo que a presidente Dilma afirmou recentemente que incentivos fiscais serão dados a empresas brasileiras para gerar empregos, esse apoio prevê a formação de jovens cientistas que possam ter impacto na ciência brasileira.
Entretanto, para que esse programa possa ter sucesso dois aspectos são fundamentais:
1) Deve haver critérios científicos muito bem embasados para selecionar os estudantes, os laboratórios que vão recebê-los no exterior e os projetos de pesquisa. A recusa do CNPq em apoiar certos projetos ou dar bolsas a alguns estudantes tem se baseado na opinião de pesquisadores qualificados que analisam cuidadosamente todos esses pontos. Além disso, temos visto casos de estudantes brasileiros radicados no exterior, que não têm nenhuma intenção de voltar ao Brasil, mas veem nessas bolsas a possibilidade de receber um auxílio adicional em condições muito menos competitivas que as exigidas no primeiro mundo.
2) Ao voltar, os estudantes precisam encontrar no Brasil laboratórios com condições comparáveis às do exterior para desenvolver suas pesquisas. Caso contrário todo o investimento terá sido inútil. Nesse sentido, um aspecto fundamental refere-se à agilidade para importar insumos para pesquisas. Temos batido nessa tecla repetidamente. Várias iniciativas positivas já foram tomadas pelos órgãos públicos e agências de fomento, mas ainda estamos longe do ideal. Continuamos com grandes empecilhos. Algumas medidas muito simples poderiam fazer uma enorme diferença e o melhor de tudo, gerar uma enorme economia não só de tempo, mas também de recursos. Poderíamos fazer muito MAIS com MENOS.
COMO DEVERIAM SER AS IMPORTAÇÕES DE INSUMOS PARA PESQUISA CIENTÍFICA?
Quais são os entraves?
O Brasil que destaca-se mundialmente pela eficiência em programas de votação ou declaração de imposto de renda por meio eletrônico ainda usa papel, carimbos e assinaturas (do pesquisador responsável e do dirigente da instituição) para autorizar cada reagente a ser importado para projetos de pesquisa. Isso, sem falar dos despachantes e burocracias para liberar os produtos da alfândega. Ou das greves que paralisam tudo. Gasta-se muito mais tempo para viabilizar uma pesquisa do que para executá-la. É dificil de acreditar, não? Com isso insumos requeridos para experimentos científicos inovadores – que chegam em apenas algumas horas às mãos dos pesquisadores no primeiro mundo, permitindo que testam imediatamente suas ideias - levam semanas e às vezes meses para chegar aos laboratórios brasileiros. Como competir com laboratórios internacionais de ponta quando a rapidez na pesquisa é crucial? Impossível.
Como mudar esse quadro? Qual é a receita?
É muito simples.
1) Todos os pesquisadores brasileiros nas universidades ou institutos de pesquisas estão cadastrados no sistema Lattes do CNPq, uma plataforma excelente. Basta colocar o nome e aparece a sua biografia científica e linhas de pesquisa.
2) Com raras exceções, os reagentes necessários para as pesquisas são conhecidos, catalogados e já aprovados por agências reguladoras nacionais e internacionais. Bastaria ter uma lista de todos eles em bancos de dados acessíveis para qualquer pesquisador, via internet.
3) As agências financiadoras ao apoiar e destinar recursos aos projetos de pesquisas alocam um certo montante para material importado. Porque não vincular esse valor a um cartão de crédito com o nome do pesquisador responsável no mesmo limite aprovado para pesquisa?
Como seria na prática o programa ?
Toda vez que um pesquisador – já cadastrado – precisasse de um reagente bastaria colocar o nome do produto e solicitar sua importação. O programa “importe-pesquisa” ou “ reagentes sem fronteiras” localizaria o código do material, o fabricante e deduziria o valor do total de verbas de importação do pesquisador. E o melhor de tudo. O produto poderia ser entregue diretamente ao pesquisador pelo fabricante, no seu laboratório, sem ter que passar por alfândega, despachante e outros entraves burocráticos. Do mesmo modo que se importam livros.
Quais seriam as vantagens?
Além da agilidade para importar material de pesquisas esse sistema poderia gerar uma grande economia não só dispensando os agentes intermediários, mas permitindo que se importasse somente o reagente necessário para aquele experimento, sem necessidade de estoques, perda de material etc.. Cada pesquisador seria o responsável pelos insumos importados.
Presidente Dilma, dê um voto de confiança aos cientistas brasileiros
Repito aqui um apelo que já fiz várias vêzes: presidente Dilma, dê um voto de confiança aos pesquisadores. Tenho certeza que essas medidas, se implementadas, serão aplaudidas por todos os cientistas brasileiros e por aqueles que lutam por um país melhor. Elas poderão ser fundamentais para que o programa “Ciência sem Fronteiras” alcance os objetivos desejados e resulte em um salto qualitativo na ciência e tecnologia do Brasil.
Por Mayana Zatz
Clique aqui e leia a matéria no site da Veja
USP vai criar banco de células-tronco - Veja - 12/05/2012
Banco permitirá que testes de novos medicamentos sejam mais precisos.
Pesquisadores da Universidade de São Paulo (USP) querem criar o primeiro banco de células-tronco de pluripotência induzida (iPSC, na sigla em inglês) da América Latina. As iPSC são células adultas modificadas pelos cientistas para recuperar sua capacidade de gerar qualquer outra célula do organismo. O banco será útil para a realização de testes de medicamentos in vitro.
"Se você tem uma droga que pode causar arritmia em algumas pessoas, a melhor estratégia pode ser obter células cardíacas do paciente e ver como elas reagem ao medicamento in vitro", afirma a geneticista Lygia da Veiga Pereira, chefe do Laboratório Nacional de Células-tronco Embrionárias (Lance) da USP. "Se apresentarem arritmia, você não precisará administrar a droga no paciente para descobrir o risco. Desta forma, diminuímos o número de reações adversas."
Uma forma de obter as células cardíacas do exemplo dado por Lygia é realizar uma biópsia do coração. "Mas, na maioria das vezes, o risco de um procedimento tão invasivo não compensa", aponta a pesquisadora. Com as iPSCs, no entanto, os especialistas podem extrair células da pele ou do sangue - ao alcance da mão dos médicos -, induzir sua pluripotência e diferenciá-la no tecido em que desejam realizar os testes.
Desta forma, é possível, por exemplo, diferenciar as iPSCs de um paciente em neurônios para testar a eficácia de um antidepressivo, em células hepáticas para testar a absorção de um medicamento ou em células cardíacas para prever um possível efeito adverso.
Perfil genético — O projeto dos pesquisadores da USP, no entanto, não se limitará a analisar a resposta de pacientes específicos a determinados tipos de fármaco. Eles pretendem criar um verdadeiro banco de iPSCs que ofereça uma amostragem fidedigna do perfil genético da população paulista e brasileira.
Populações de diferentes etnias, países ou regiões podem apresentar uma diversidade significativa na resposta a determinados remédios. Em 2005, por exemplo, o FDA — agência de vigilância sanitária americana — aprovou uma droga para insuficiência cardíaca específica para a população negra. Os testes clínicos mostraram resultados tímidos em americanos brancos, mas os benefícios foram evidentes para negros.
Testes mais precisos — Em média, de cada mil substâncias testadas pela indústria farmacêutica, só uma chega às prateleiras das farmácias. Quanto mais cedo os laboratórios descobrem a inviabilidade de uma droga — por apresentar alta toxicidade ou baixa eficácia —, menos dinheiro e tempo são jogados fora.
"Um banco como esse que vamos criar possibilitará identificar substâncias inviáveis e promissoras mais rápido, economizando muito dinheiro", aponta Paulo Lotufo, diretor da Divisão de Clínica Médica do Hospital Universitário da USP. Ele diz que as precárias condições em que são realizados os testes pré-clínicos — em animais — no país torna a alternativa das iPSCs ainda mais atraente. "Já que não temos animais em condições ideais para realizar os testes dos fármacos, poderemos testá-los em células humanas in vitro."
Apesar de não substituir os testes em animais, Lygia aponta que as iPSCs possuem algumas vantagens. "O camundongo, por exemplo, é muito diferente do ser humano para testes que envolvem o tecido cardíaco", afirma a pesquisadora. "O coração do roedor bate 600 vezes por minuto. O nosso, cerca de 80 vezes. Além disso, há importantes diferenças no tamanho, na pressão sanguínea e na suscetibilidade a ataque cardíaco."
Projeto — Lotufo pretende coletar as amostras de sangue para o banco de iPSCs no contexto do Estudo Longitudinal de Saúde do Adulto (Elsa), um imenso projeto que procura investigar a incidência e os fatores de risco para doenças crônicas em uma população composta por 15.000 funcionários de seis instituições públicas de ensino superior e pesquisa das regiões Nordeste, Sul e Sudeste do Brasil. É o maior estudo do tipo já realizado na América Latina.
"Vamos criar o banco de dados com todos os voluntários da amostra paulista, que representa cerca de um terço do universo do Elsa", aponta Lotufo. Além disso, o pesquisador também gostaria de incluir outros mil voluntários de centros do Elsa de outras regiões do País. Se tudo der certo, o banco de dados incluirá iPSCs de cerca de 6.000 pessoas.
(Com informações da Agência Estado)
Leia a matéria no site da Veja
Reprogramação campeã - Ciência Hoje - 24/02/2012
Usando células-tronco reprogramadas de paciente com síndrome de Down, pesquisadores conseguem estudar o desenvolvimento precoce do Alzheimer. Na ‘Bioconexões’ de fevereiro, Stevens Rehen descreve o feito, que consagra a aplicação da técnica na biomedicina.
Assim como os blocos carnavalescos proliferaram pelas ruas do Rio de Janeiro em fevereiro, ótimos artigos sobre o Alzheimer foram publicados nas melhores revistas científicas do mundo ao longo deste mês, mostrando avanços no entendimento dessa doença que acomete mais de 1 milhão de brasileiros.
Aproveito esta coluna para descrever um deles, que se baseia na técnica de reprogramação celular. Dessa vez o mérito é de cientistas da Universidade de Cambridge, na Inglaterra, e do Instituto de Células-Tronco de Harvard, nos Estados Unidos.
Como sabemos, há uma concordância impressionante entre a doença de Alzheimer e a síndrome de Down – a última caracterizada pela presença de três cromossomos 21, em vez de dois. Essa concordância é tamanha que a incidência de Alzheimer entre os portadores da síndrome de Down com idade superior a 50 anos é de 100%.
A alta prevalência de Alzheimer nos portadores da síndrome de Down é atribuída ao excesso de produção da proteína precursora amiloide (APP), cujo gene se localiza justamente no cromossomo 21. Há outros genes no cromossomo 21 que contribuem para o risco aumentado de demência em pessoas com síndrome de Down, como o que codifica a enzima que fosforila a tau, uma proteína que ajuda a estabilizar o citoesqueleto celular.
Legenda: No cérebro de pacientes com Alzheimer, enzimas atuam na proteína precursora amiloide (APP), cortando-a em fragmentos. A produção excessiva desses fragmentos beta-amiloide (Aβ), que também ocorre em indivíduos com Down, é crucial para a formação de placas senis. (esquema: National Institute on Aging).
Surgimento precoce
As primeiras análises foram de certa maneira desapontadoras, visto que os cientistas não conseguiram identificar diferenças morfológicas entre os neurônios gerados a partir das iPS do portador da síndrome de Down e do controle. Da mesma forma, não notaram alterações na maneira como essas células se comunicavam entre si.
No entanto, ao acompanhar por dois meses o curso-temporal do acúmulo dos peptídeos Aβ40 e Aβ42 gerados pelos neurônios produzidos no laboratório, os autores chegaram aos primeiros resultados relevantes. Após esse período, os neurônios criados a partir das células iPS do portador da síndrome de Down produziram pelo menos seis vezes mais peptídeos Aβ40 e Aβ42 do que os neurônios do indivíduo saudável.
Por outro lado, as células da pele e as células iPS indiferenciadas do portador da síndrome de Down não produziram tanto Aβ40 e Aβ42, o que indica que aumentos nos níveis desses peptídeos só acontecem mesmo nos neurônios.
O curto período de tempo para a identificação dos biomarcadores da doença de Alzheimer nos neurônios com Down pode ser comparado ao observado nas crianças e adolescentes portadores da trissomia do cromossomo 21 que já possuem níveis significativamente aumentados de Aβ42 solúvel ou placas amiloides. Pessoas com Down em geral possuem essa predisposição para o aparecimento precoce dos sinais biológicos da doença de Alzheimer, apesar do início da demência ocorrer geralmente na meia-idade desses indivíduos.
A aplicação por quatro dias de um medicamento já utilizado no tratamento do Alzheimer, capaz de inibir o complexo enzimático gama secretase, crucial para a quebra de APP, reduziu pela metade a geração dos peptídeos Aβ, enquanto que o tratamento mais prolongado com esse mesmo medicamento (por 21 dias) reduziu a secreção desses peptídeos a níveis indetectáveis. Esses resultados confirmam a utilidade das células iPS na identificação de marcas precoces e também de novos agentes terapêuticos para tratar essa patologia.
Surgimento precoce
As primeiras análises foram de certa maneira desapontadoras, visto que os cientistas não conseguiram identificar diferenças morfológicas entre os neurônios gerados a partir das iPS do portador da síndrome de Down e do controle. Da mesma forma, não notaram alterações na maneira como essas células se comunicavam entre si.
No entanto, ao acompanhar por dois meses o curso-temporal do acúmulo dos peptídeos Aβ40 e Aβ42 gerados pelos neurônios produzidos no laboratório, os autores chegaram aos primeiros resultados relevantes. Após esse período, os neurônios criados a partir das células iPS do portador da síndrome de Down produziram pelo menos seis vezes mais peptídeos Aβ40 e Aβ42 do que os neurônios do indivíduo saudável.
Por outro lado, as células da pele e as células iPS indiferenciadas do portador da síndrome de Down não produziram tanto Aβ40 e Aβ42, o que indica que aumentos nos níveis desses peptídeos só acontecem mesmo nos neurônios.
O curto período de tempo para a identificação dos biomarcadores da doença de Alzheimer nos neurônios com Down pode ser comparado ao observado nas crianças e adolescentes portadores da trissomia do cromossomo 21 que já possuem níveis significativamente aumentados de Aβ42 solúvel ou placas amiloides. Pessoas com Down em geral possuem essa predisposição para o aparecimento precoce dos sinais biológicos da doença de Alzheimer, apesar do início da demência ocorrer geralmente na meia-idade desses indivíduos.
A aplicação por quatro dias de um medicamento já utilizado no tratamento do Alzheimer, capaz de inibir o complexo enzimático gama secretase, crucial para a quebra de APP, reduziu pela metade a geração dos peptídeos Aβ, enquanto que o tratamento mais prolongado com esse mesmo medicamento (por 21 dias) reduziu a secreção desses peptídeos a níveis indetectáveis. Esses resultados confirmam a utilidade das células iPS na identificação de marcas precoces e também de novos agentes terapêuticos para tratar essa patologia.
Legenda: O gráfico mostra o aumento significativamente maior da produção de peptídeos Aβ em neurônios gerados a partir de células iPS do portador de Down (Nn iPS-Down) em comparação ao verificado nos neurônios do indivíduo saudável (Nn iPS-Ctrl) e dos fibroblastos do paciente de Down (F´blastos-Down) após 70 dias de observação. A aplicação por 4 dias do inibidor do complexo gama secretase reduziu a secreção de Aβ40 e Aβ42 a quase metade nos Nn iPS-Down. Após 21 dias de aplicação, a produção dos peptídeos baixou a níveis indetectáveis. (imagem: adaptação do gráfico publicado na Science/ AAAS)
Abordagem inovadora
Devido ao aumento observado na produção de Aβ40 e Aβ42 pelos neurônios corticais criados a partir das células iPS do portador da síndrome de Down, os pesquisadores resolveram acompanhar em tempo real a formação das placas amiloides, usando para isso um corante capaz de detectar agregados em células vivas.
Constataram que neurônios gerados a partir das células iPS-Down apresentavam esses agregados, enquanto o mesmo não foi observado nos neurônios saudáveis. A própria razão Aβ40:Aβ42 foi alterada e os neurônios do portador da síndrome de Down aumentaram desproporcionalmente a produção de Aβ42 (a forma mais patogênica do peptídeo), de forma semelhante ao observado no cérebro de pacientes com Alzheimer.
Outros fenômenos característicos da doença de Alzheimer foram observados nos neurônios gerados a partir das células iPS do portador da síndrome de Down, como a hiperfosforilação da proteína tau e o nível alto da forma solúvel dessa proteína no ambiente extracelular.
Curiosamente, os autores também observaram uma quantidade bastante aumentada de células mortas nas culturas dos neurônios do portador da síndrome de Down quando comparada ao controle, sugerindo que a morte celular é a principal causa do extravasamento de tau para o exterior das células.
Uma observação surpreendente do estudo é que todos esses fenômenos foram detectados somente nos neurônios, e não nos fibroblastos ou nas células iPS indiferenciadas do portador da síndrome de Down. Isto é particularmente notável, levando-se em consideração que a expressão aumentada de APP, em virtude das três cópias do cromossomo 21, estaria presente em todos esses tipos celulares.
Por outro lado, como as características patológicas do Alzheimer são observadas no cérebro, esse modelo permitirá abordagens inovadoras a respeito da especificidade e vulnerabilidade seletiva do cérebro à doença.
Da mesma forma que Paulo Barros consagra-se em definitivo no carnaval carioca, os modelos biológicos baseados na reprogramação celular assim o fazem na área biomédica, inovando a maneira de se estudar as doenças humanas e vindo para ficar.
Veja a matéria no site da Ciência Hoje
Stevens Rehen
Instituto de Ciências Biomédicas - UFRJ
Coordenador do CTC LaNCE
Modelo ideal - Ciência Hoje - 27/11/2012
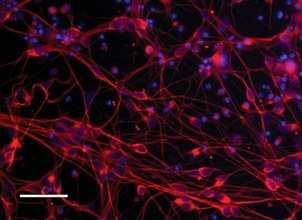
Por meio do estudo de neurônios criados a partir de células da pele de pacientes com Alzheimer, pesquisadores norte-americanos obtêm dados inéditos sobre mecanismos envolvidos no desenvolvimento da doença. O feito é tema da coluna deste mês de Stevens Rehen.
O estudo das doenças do cérebro humano é fascinante, porém extremamente desafiador.
O neurocientista tem as seguintes opções: 1) analisar o tecido nervoso de pessoas já falecidas, material difícil de ser obtido e que representa na maioria das vezes estágios terminais das neuropatologias; 2) usar animais de experimentação, que, apesar de extremamente úteis, em muitos casos são incapazes de reproduzir várias das características dessas doenças; 3) utilizar células do sangue de pacientes acometidos por doenças neurodegenerativas ou demências. Neste último caso, apesar de essas células ajudarem na identificação de marcadores genéticos dessas patologias, a maioria das características metabólicas de doenças que acometem o cérebro não necessariamente é observada fora dele.
A reprogramação celular, técnica desenvolvida originalmente no Japão e reproduzida em alguns países, inclusive o Brasil, vem se destacando como ferramenta sem precedentes para a modelagem experimental de doenças humanas, complementando o que já aprendemos com os cérebros pós-mortem, animais de experimentação ou células sanguíneas dos pacientes.
Como já discutido em outras oportunidades aqui mesmo nesta coluna, as células-tronco de pluripotência induzida (conhecidas pela sigla iPS), obtidas por meio dessa técnica, podem ser geradas a partir de fragmentos da pele de seres humanos.
Desses fragmentos, são extraídos fibroblastos que, expostos a vírus modificados, que carregam genes idênticos àqueles presentes em células-tronco embrionárias, adquirem uma capacidade (chamada pluripotência) de se transformar em qualquer outro tipo celular do corpo humano.
Ao conseguir criar células especializadas de diferentes órgãos a partir de um punhado de pele, os cientistas são capazes de aprender sobre os estágios iniciais das doenças humanas e também identificar novos medicamentos que poderão ser aplicados de forma customizada em cada paciente. É a medicina personalizada, bebê!
Nos últimos anos, diversas doenças vêm sendo modeladas em laboratório pela técnica de reprogramação celular. Especificamente no caso do sistema nervoso, as doenças já estudadas incluem esclerose lateral amiotrófica, atrofia muscular espinhal, disautomia familiar, autismo, síndrome do X frágil e esquizofrenia.
Nesta semana, pesquisadores do Instituto de Pesquisas Salk, da Califórnia (EUA), criaram células iPS para estudar também a doença de Alzheimer.
Mecanismos por trás da patologia
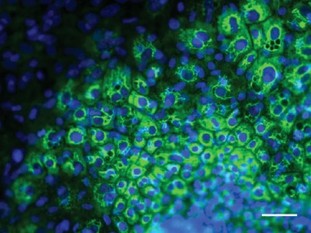
A doença de Alzheimer é uma doença neurodegenerativa incapacitante caracterizada pelo aumento da presença de placas beta-amiloides (tipo de depósito de proteínas) e emaranhados neurofibrilares (agregações intracelulares de certa proteína) nos cérebros dos pacientes.
No Brasil, estima-se que haja mais de 1 milhão de pessoas com Alzheimer. O aumento nos casos dessa demência incapacitante está associado ao aumento da expectativa de vida em todo o mundo. Atualmente, essa é a principal forma de demência em pessoas com mais de 60 anos.
Embora a grande maioria dos casos de Alzheimer seja esporádico, os principais avanços no conhecimento sobre os mecanismos dessa neuropatologia surgiram a partir do estudo de casos familiares da doença, herdados.
Nesse novo estudo publicado na revista Nature, o grupo liderado por Larry Goldstein reprogramou fibroblastos extraídos da pele de quatro pacientes com Alzheimer – dois com a forma esporádica da doença e outros dois com a forma familiar –, e de duas pessoas sem a doença (controles). As células iPS reprogramadas foram diferenciadas em neurônios.
Primeiramente, os autores confirmaram o aumento dos três grandes marcadores bioquímicos da doença de Alzheimer nos neurônios dos pacientes quando comparados aos dos controles.
Esses neurônios, diferenciados a partir das células iPS dos pacientes, foram então tratados com inibidores de beta-secretase, enzima envolvida na formação das placas amiloides. Além de reduzir a produção dos peptídeos beta-amiloides que formam as placas, a inibição dessa enzima foi capaz de fazer o mesmo com a proteína que forma os emaranhados neurofibrilares.
Resultados questionáveis?
Um questionamento à relevância desses resultados está na diferença “de idade” entre os neurônios criados a partir das células iPS e os neurônios localizados no cérebro dos pacientes, cuja faixa etária variou entre 51 e 83 anos. Neurônios gerados em três semanas seriam comparáveis a neurônios com décadas de vida?
Enquanto há um debate sobre quando as características celulares da doença de Alzheimer começam a surgir, há evidências de que essa doença pode ocorrer em fetos com síndrome de Down de 28 semanas. Portanto, a relação causal entre formação de placas e emaranhados observada nos neurônios é provavelmente real. Mas não há outra forma de comprová-la que não seja por meio de células iPS.
Os resultados desse estudo indicam que a técnica de reprogramação celular, combinada ao conhecimento gerado a partir dos estudos com cérebros pós-mortem e modelos animais, poderá contribuir para o entendimento da patogênese precoce e da resposta a medicamentos em pacientes com as formas esporádica e familiar da doença de Alzheimer.
Não é por acaso que esse trabalho foi realizado na Califórnia. O investimento em pesquisas sobre células-tronco e a concentração de cientistas especializados no tema fazem com que a geração de conhecimento naquele estado norte-americano seja 20 vezes superior à produção científica sobre o mesmo assunto realizada em todo o Brasil.
Pesquisadores do estado da Califórnia já publicaram mais de mil artigos sobre células-tronco embrionárias e/ou iPS nos últimos 30 anos, enquanto no mesmo período foram publicados menos de cinquenta trabalhos científicos sobre esses assuntos no Brasil.
A medicina personalizada é baseada na proposta do desenvolvimento de medicamentos específicos para o tratamento individualizado de cada paciente, com maior eficácia e sem efeitos colaterais. Essa revolução na área da saúde passará impreterivelmente pela utilização da reprogramação celular e geração de células iPS.
A integração entre a pesquisa básica e a clínica, ou, em outras palavras, o diálogo constante entre pesquisadores e médicos, é imprescindível para o sucesso dessa proposta, assim como a continuidade e o aumento de investimentos em pesquisas sobre células-tronco e reprogramação celular no Brasil.
A revolução já começou, pelo menos na Califórnia.
Veja a matéria no site da Ciência Hoje.
Stevens Rehen
Instituto de Ciências Biomédicas
Universidade Federal do Rio de Janeiro
Células-tronco jovens e camundongos geneticamente idosos - Veja on line - 19/01/2012

As células-tronco adultas presentes em vários tecidos e órgãos do nosso corpo (tais como a medula óssea, o tecido adiposo, o fígado, o pulmão e o tecido muscular entre outros) têm um papel importante na regeneração dos tecidos. Com o envelhecimento, porém, ocorre uma diminuição nessa capacidade de regenerar e, consequentemente, maior morbidade (doenças) e mortalidade. Uma possível hipótese para isso seria a perda da função regenerativa das células-tronco adultas com o envelhecimento. De fato, já foi demonstrado que, em camundongos mais velhos (mais de dois anos), há diminuição do número e da capacidade proliferativa de alguns tipos de células-tronco, como as neurais, entre outras.
Não se sabe, entretanto, se células-tronco “idosas” contribuem para o processo de envelhecimento, ou se sua presença são uma característica de um tecido envelhecido. Uma nova pesquisa publicada por pesquisadores americanos (Nature Communication, 3 de janeiro) com células-tronco (CT) de músculo de animais jovens e camundongos idosos comprova que, no tecido muscular, as CT têm um papel importante na perda do potencial regenerativo que ocorre com a idade.
Como foi feita a pesquisa?
Os cientistas, liderados por Johnny Huard, valeram-se de um tipo especial de células-tronco derivadas do músculo (CTDM) ou (MDSPC- muscle derived stem/progenitor cells em inglês) que atuam supostamente na regeneração desse tecido. Como o músculo esquelético é claramente comprometido durante o envelhecimento, esse é um bom parâmetro a ser pesquisado.
Para testar a hipótese segundo a qual as CTDM perdem a sua função, os pesquisadores fizeram vários experimentos envolvendo camundongos jovens (3 semanas de vida), camundongos idosos (2 anos) e camundongos transgênicos “geneticamente velhos”, isto é, afetados por progeria, uma síndrome que causa envelhecimento acelerado. Esses animais, além de apresentarem várias características de camundongos velhos, têm uma sobrevida muito encurtada (um mês).
A capacidade de proliferação das CTDM diminui com o envelhecimento
Quando cultivadas em laboratório, os cientistas observaram que as CTDM obtidas de animais velhos ou com progeria tinham uma capacidade de proliferação diminuída em comparação com as CTDM jovens. Os pesquisadores então cultivaram as CTDM “velhas” juntamente com as obtidas de camundongos jovens e tiveram um primeiro resultado positivo: elas recuperaram a capacidade de proliferação e começaram a se comportar como jovens. Segundo os autores, a hipótese para explicar isso seria a liberação de fatores pelas CTDM jovens no meio de cultura que estimulariam a regeneração das CT mais velhas.
Transplante de CTDM jovem recupera animais idosos
Para avaliar qual seria o papel dessas células jovens “in vivo”, os pesquisadores as injetaram no peritônio (cavidade abdominal ) dos camundongos com progeria. Observaram que os animais aumentaram de peso, tiveram menos atrofia muscular e houve uma neo vascularização (aumento de vasos sanguíneos) nos músculos e cérebro dos animais injetados. Quando injetaram CTDM “jovens” diretamente no músculo de animais com progeria também houve um efeito benéfico: maior regeneração e aumento de vasos sanguíneos. Os cientistas também chamam a atenção para um fato muito importante. Apesar dos benefícios inegáveis, não foram encontradas CTDM “jovens” nos músculos dos animais transplantados . Isso sugere que não foi a reconstituição dos tecidos diretamente responsável pela melhora clínica e maior sobrevida dos animais injetados, mas sim importantes fatores secretados pelas CTDM jovens que estimulariam a regeneração e que seriam gradativamente perdidos durante o envelhecimento. Descobrir agora quais são esses fatores vai ser fundamental.
Uma injeção de ânimo
Embora animados com os resultados dessa pesquisa, o Dr. Huard e equipe sugerem que ela deve ser repetida com outros tipos de células-tronco. Como a nossa equipe no Centro do Genoma Humano vem trabalhando exatamente nesse sentido, os dados que acabam de ser publicados por esse grupo me deixam muito entusiasmada. Isso porque já pesquisamos outras fontes de células-tronco (células tronco humanas derivadas de tecido adiposo e cordão umbilical) que foram injetadas em outros modelos animais (camundongos afetados por distrofia muscular progressiva) e nossos resultados são muito comparáveis.
Também observamos uma melhora clínica em camundongos com duas formas de distrofia muscular progressiva (uma doença genética onde há degeneração progressiva da musculatura e às vezes morte precoce) injetados com células-tronco humanas de tecido adiposo e cordão umbilical, embora não tenhamos encontrado essas últimas nos músculos dos animais transplantados.
É mais uma evidência de que realmente seriam fatores liberados pelas células-tronco injetadas e não as próprias células que atuariam na melhora clínica dos animais com distrofia. É uma grande injeção de ânimo.
Por Mayana Zatz
Veja a matéria no site da Veja
Células-tronco sofrem mudanças cromossômicas depois de longo tempo em cultura - Pesquisa envolveu pesquisadores da RNTC (LaNCE-USP) - Agência FAPESP - 18/01/2012
Agência FAPESP – Quando são mantidas por longo tempo em cultura, as células-tronco embrionárias humanas apresentam alterações cromossômicas que podem comprometer as condições ideais para aplicações terapêuticas, de acordo com um amplo estudo internacional realizado com participação brasileira.
A pesquisa, que foi capa da edição de dezembro da revista Nature Biotechnology, analisou 125 linhagens de células-tronco embrionárias humanas e 11 linhagens de células-tronco pluripotentes induzidas. O objetivo era identificar possíveis mudanças genéticas em culturas in vitro ao longo do tempo.
O trabalho foi coordenado pela International Stem Cell Initiative (ISCI), que envolve 38 laboratórios de todo o mundo, incluindo o Laboratório Nacional de Células-tronco Embrionárias (LaNCE), do Instituto de Biociências (IB) da Universidade de São Paulo (USP), coordenado por Lygia da Veiga Pereira.
O grupo do LaNCE obteve, em 2008, a primeira linhagem de células-tronco desenvolvida na América Latina, a BR-1, cujas amostras foram agora utilizadas no estudo da ISCI. Além de Pereira, o estudo teve a participação de sua orientanda Ana Fraga, que cursa doutorado no IB-USP com bolsa da FAPESP.
Segundo Fraga, a maior parte das linhagens permanecia normal por algum tempo, em relação ao cariótipo, o conjunto de cromossomos. Mas, ao longo de um período de seis meses em cultura, as células apresentaram uma tendência progressiva a adquirir modificações, afetando os cromossomos 1, 12, 17 e 20.
“Nem todos os genes envolvidos nessas alterações cromossômicas são conhecidos. Mas sabemos que o cromossomo 20, por exemplo, tem um gene importante relacionado à morte celular. Será preciso testar, a partir de agora, até que ponto essas modificações poderiam gerar efeitos colaterais em aplicações terapêuticas”, disse à Agência FAPESP.
De acordo com a pesquisadora, já se sabia que as células cultivadas apresentam alguma instabilidade, passível de comprometer sua aplicação em terapias. Mas pela primeira vez as mudanças cromossômicas em células mantidas em cultura por longo tempo foram confirmadas por um estudo robusto.
“A vantagem deste estudo é que ele reuniu análises de mais de uma centena de linhagens de células-tronco embrionárias provenientes de diferentes origens étnicas. E tudo isso foi realizado de forma muito rigorosa, sob os mesmos parâmetros, no mesmo laboratório, com os mesmos protocolos de pesquisa e mesma metodologia”, disse.
Fraga explica que o DNA extraído de células das linhagens das várias partes do mundo, incluindo a BR-1, foi enviado para análises epigenéticas em Cingapura. Um lote de células congeladas seguiu para o Reino Unido, para a realização de análises citogenéticas.
Existe a possibilidade de que as alterações sejam selecionadas pelas atuais condições de cultivo das células. “Essa hipótese será testada em estudos futuros. As modificações, no entanto, não significam necessariamente que o cultivo inviabilize as aplicações terapêuticas das linhagens”, disse.
Aplicação e efeitos
Ao cultivar células-tronco embrionárias humanas, os cientistas “imitam” a metodologia utilizada para a análise de linhagens de células de camundongos. O que os estudos mais recentes estão mostrando, segundo Fraga, é que as células humanas não se comportam exatamente como as células murinas.
“Quando fazemos um modelo animal, as variações podem não fazer tanta diferença para o experimento. Mas em células humanas precisamos nos aproximar o máximo possível das condições in vivo, pois os resultados serão aplicados em terapias”, disse.
“Por isso, há uma preocupação com as alterações que observamos, mas acho que os resultados não são alarmantes, nem significam que a aplicação terapêutica dessas células terá de fato efeitos colaterais. Apenas confirmamos que é preciso aprofundar os estudos sobre soluções ideais para o cultivo de células-tronco embrionárias”, completou.
O artigo Screening ethnically diverse human embryonic stem cells identifies a chromosome 20 minimal amplicon conferring growth advantage, de Lygia Pereira, Ana Fraga e outros, pode ser lido por assinantes da Nature Biotechnology em www.nature.com/nbt/journal/v29/n12/full/nbt.2051.html.
Veja a matéria no site da Agência FAPESP.
Por Fábio de Castro.
Stevens Rehen do LaNCE-UFRJ e membro da RNTC, é o vencedor do Prêmio Faz Diferença 2011 - O Globo 14/01/2012

Stevens Rehen
Quando voltou ao Brasil em 2005, após cinco anos e dois pós-doutorados em neurociência nos Estados Unidos, o tijucano Stevens Rehen não encontrou lugar para seu laboratório. Com o Centro de Ciências da Saúde da UFRJ lotado, a solução foi fazer obras em um banheiro da instituição e ocupar metade dele com os equipamentos que trouxe na mala. Hoje, Rehen desfruta de um espaço de 200 metros quadrados - sete vezes maior do que o antigo banheiro - no Hospital Universitário Clementino Fraga Filho, onde coordena uma equipe de 35 pesquisadores. Ali é produzida metade de toda a ciência de células-tronco embrionárias do país. Foram 18 artigos assinados em publicações internacionais nos últimos três anos - um por bimestre, em média.
O time fabrica o seu próprio meio de cultivo de células, que era importado por R$ 3,7 mil o litro. Vinte e dois laboratórios nacionais compram o reagente de Rehen, que o vende por um preço 60% menor do que o cobrado por instituições estrangeiras. Além da economia, cientistas de todo o país também evitam aborrecimentos na alfândega, queixa recorrente entre quem se aventura a fazer pesquisa no Brasil.
A luta contra a burocracia é outra bandeira hasteada por Rehen, que já coordenou três levantamentos nos últimos seis anos entre seus pares para conferir como a dificuldade nas importações afeta a produtividade dos laboratórios. - A burocracia é o principal gargalo da ciência brasileira - avalia. - Desde 2004 converso com ministros da Saúde e de Ciência e Tecnologia. Todos estão cientes do problema, mas a máquina é tão grande e engessada que, por mais que haja boa vontade dos líderes, suas resoluções não descem até a base da pirâmide. Li um artigo de 1958 denunciando a dificuldade para a importação de reagentes que poderia ser publicado hoje no jornal. É impossível fazer uma ciência de ponta assim. Rehen, no entanto, não é de se render a qualquer aperto.
Além de denunciar a burocracia, foi a Brasília negociar, no Supremo Tribunal Federal, a liberação de pesquisas com células-tronco embrionárias. Ajudou a convencer os ministros e, agora, usa o material para buscar um tratamento para portadores de transtornos mentais como a esquizofrenia. Seu grupo reprograma células da pele de pacientes, transformando-as em neurônios, e, no processo, identifica características bioquímicas da doença. Vendo o pesquisador em tantos fronts, fica difícil imaginar que Rehen por pouco não seguiu outras carreiras - assim mesmo, no plural.
Quando adolescente, ele tentou ser jogador de vôlei. Chegou a ser atleta federado e atacante do Clube Municipal, mas uma série de derrotas para o Flamengo, então com Nalbert, o fez reavaliar a profissão. A baixa estatura e uma contusão o convenceram a dar adeus às quadras. No vestibular, inscreveu-se em comunicação social. Mudou para biologia, quando viu a preferência dos amigos pela área. E, já na universidade, investiu em uma banda de reggae, presença garantida em congressos científicos. Aposentou o bongô, seu instrumento, para dedicar-se mais aos estudos. Decisão tão acertada quanto a tomada quase 15 anos depois, quando converteu um banheiro em laboratório. - Estou muito feliz por ter abraçado o Rio - revela. - Este ano receberemos o Congresso Mundial de Biologia Celular, e, em 2015, o de Neurociência. É o momento ideal para dar à sociedade uma imagem mais próxima do que é ser cientista.
Veja a matéria no site do jornal O Globo
Renato Grandelle - [email protected]
Quando voltou ao Brasil em 2005, após cinco anos e dois pós-doutorados em neurociência nos Estados Unidos, o tijucano Stevens Rehen não encontrou lugar para seu laboratório. Com o Centro de Ciências da Saúde da UFRJ lotado, a solução foi fazer obras em um banheiro da instituição e ocupar metade dele com os equipamentos que trouxe na mala. Hoje, Rehen desfruta de um espaço de 200 metros quadrados - sete vezes maior do que o antigo banheiro - no Hospital Universitário Clementino Fraga Filho, onde coordena uma equipe de 35 pesquisadores. Ali é produzida metade de toda a ciência de células-tronco embrionárias do país. Foram 18 artigos assinados em publicações internacionais nos últimos três anos - um por bimestre, em média.
O time fabrica o seu próprio meio de cultivo de células, que era importado por R$ 3,7 mil o litro. Vinte e dois laboratórios nacionais compram o reagente de Rehen, que o vende por um preço 60% menor do que o cobrado por instituições estrangeiras. Além da economia, cientistas de todo o país também evitam aborrecimentos na alfândega, queixa recorrente entre quem se aventura a fazer pesquisa no Brasil.
A luta contra a burocracia é outra bandeira hasteada por Rehen, que já coordenou três levantamentos nos últimos seis anos entre seus pares para conferir como a dificuldade nas importações afeta a produtividade dos laboratórios. - A burocracia é o principal gargalo da ciência brasileira - avalia. - Desde 2004 converso com ministros da Saúde e de Ciência e Tecnologia. Todos estão cientes do problema, mas a máquina é tão grande e engessada que, por mais que haja boa vontade dos líderes, suas resoluções não descem até a base da pirâmide. Li um artigo de 1958 denunciando a dificuldade para a importação de reagentes que poderia ser publicado hoje no jornal. É impossível fazer uma ciência de ponta assim. Rehen, no entanto, não é de se render a qualquer aperto.
Além de denunciar a burocracia, foi a Brasília negociar, no Supremo Tribunal Federal, a liberação de pesquisas com células-tronco embrionárias. Ajudou a convencer os ministros e, agora, usa o material para buscar um tratamento para portadores de transtornos mentais como a esquizofrenia. Seu grupo reprograma células da pele de pacientes, transformando-as em neurônios, e, no processo, identifica características bioquímicas da doença. Vendo o pesquisador em tantos fronts, fica difícil imaginar que Rehen por pouco não seguiu outras carreiras - assim mesmo, no plural.
Quando adolescente, ele tentou ser jogador de vôlei. Chegou a ser atleta federado e atacante do Clube Municipal, mas uma série de derrotas para o Flamengo, então com Nalbert, o fez reavaliar a profissão. A baixa estatura e uma contusão o convenceram a dar adeus às quadras. No vestibular, inscreveu-se em comunicação social. Mudou para biologia, quando viu a preferência dos amigos pela área. E, já na universidade, investiu em uma banda de reggae, presença garantida em congressos científicos. Aposentou o bongô, seu instrumento, para dedicar-se mais aos estudos. Decisão tão acertada quanto a tomada quase 15 anos depois, quando converteu um banheiro em laboratório. - Estou muito feliz por ter abraçado o Rio - revela. - Este ano receberemos o Congresso Mundial de Biologia Celular, e, em 2015, o de Neurociência. É o momento ideal para dar à sociedade uma imagem mais próxima do que é ser cientista.
Veja a matéria no site do jornal O Globo
Renato Grandelle - [email protected]
Células-tronco de polpa dentária promovem regeneração da medula espinhal em ratos - 08/12/11
Matéria extraída da página da Revista Veja - Mayana Zatz é pesquisadora da RNTC.
Um grupo de pesquisadores da universidade de Nagoya, no Japão, acaba de publicar uma pesquisa muito promissora: a partir de células-tronco (CT) obtidas de polpa dentária humana – que tem o potencial de diferenciar-se em células ósseas, cartilaginosas, adiposas e também neurônios em condições especiais de cultivo – eles conseguiram regenerar a medula espinhal que havia sido seccionada em ratos adultos e recuperar a função locomotora das suas patas traseiras. O trabalho, liderado por Minori Ueda, foi publicado na prestigiosa revista The Journal of Clinical Investigation.
O que tem mostrado outros estudos pré-clínicos com CT na regeneração da medula?
A identificação de CT capazes de recuperar a medula espinhal após injúria tem sido objeto de muita investigação. Na última década células-tronco de diferentes origens (incluindo CT humanas neurais, CT derivadas de embriões e CT da medula óssea) foram transplantadas em ratos ou camundongos que haviam sofrido lesão da medula e seus efeitos foram avaliados. Entretanto as pesquisas mostraram que essas células tinham uma sobrevida e/ou capacidade de regeneração reduzida com pouco benefício terapêutico.
Como foi feita essa nova pesquisa do grupo japonês?
Os cientistas obtiveram CT da polpa dentária de dentes de leite e de adultos (dente de siso) e o primeiro passo foi verificar se elas conseguiam se diferenciar em cultura em células neurais, isto é, se elas expressavam vários fatores que são característicos de células nervosas. É importante lembrar que existem vários tipos de células nervosas que são necessários para se recuperar a função sensorial e motora após uma lesão de medula. Uma vez confirmado que as CT da polpa dentária expressavam fatores característicos de diferentes células neurais elas foram transplantadas em ratos imediatamente após esses terem sido submetidos a uma secção total da medula espinhal. Para verificar se os resultados dependiam das propriedades das CT da polpa dentária e não da metodologia empregada os cientistas usaram como controles dois grupos de ratos submetidos ao mesmo experimento: no primeiro grupo injetaram CT da medula óssea e no segundo fibroblastos ( células derivadas da pele).
Quais foram os resultados?
Ratos que haviam sido transplantados com CT de polpa dentária humana – tanto de dente de leite, como adulto – mostraram uma recuperação muito superior à observada nos grupos injetados com CT de medula óssea ou fibroblastos. Essa melhoria foi observada logo após a operação durante a fase aguda da lesão medular. Cinco semanas após o transplante, os ratos com CT de polpa dentária eram capazes de locomover as patas traseiras de modo coordenado, enquanto os dois outros grupos só conseguiam movimentos sutis. De acordo com os pesquisadores, a observação de que os animais conseguiram recuperar os movimentos sugerem que as CT derivadas da polpa dentária foram capazes de promover também a regeneração dos axonios, as terminações nervosas que são projetadas a partir dos neurônios da medula espinhal.
Em resumo as perspectivas são otimistas
As CT derivadas de polpa dentária mostraram uma capacidade neuroregenerativa significante quando injetadas em ratos imediatamente após a secção da medula espinhal . Houve inibição da morte dos neurônios e células da bainha de mielina (a bainha que recobre as terminações nervosas) após a injúria, regeneração dos axonios (terminações nervosas) e substituição de oligodendrócitos lesionados (as células responsáveis pela formação e manutenção das bainhas de mielina) por oligodendrócitos maduros. Entretanto os pesquisadores reconhecem que esses resultados só foram obtidos imediatamente após a secção total da medula – o que certamente não poderá ser avaliado em seres humanos – e não sabemos quais seriam os resultados em diferentes lesões da medula. De qualquer modo essa pesquisa abre perspectivas muito otimistas.
Por Mayana Zatz
Um grupo de pesquisadores da universidade de Nagoya, no Japão, acaba de publicar uma pesquisa muito promissora: a partir de células-tronco (CT) obtidas de polpa dentária humana – que tem o potencial de diferenciar-se em células ósseas, cartilaginosas, adiposas e também neurônios em condições especiais de cultivo – eles conseguiram regenerar a medula espinhal que havia sido seccionada em ratos adultos e recuperar a função locomotora das suas patas traseiras. O trabalho, liderado por Minori Ueda, foi publicado na prestigiosa revista The Journal of Clinical Investigation.
O que tem mostrado outros estudos pré-clínicos com CT na regeneração da medula?
A identificação de CT capazes de recuperar a medula espinhal após injúria tem sido objeto de muita investigação. Na última década células-tronco de diferentes origens (incluindo CT humanas neurais, CT derivadas de embriões e CT da medula óssea) foram transplantadas em ratos ou camundongos que haviam sofrido lesão da medula e seus efeitos foram avaliados. Entretanto as pesquisas mostraram que essas células tinham uma sobrevida e/ou capacidade de regeneração reduzida com pouco benefício terapêutico.
Como foi feita essa nova pesquisa do grupo japonês?
Os cientistas obtiveram CT da polpa dentária de dentes de leite e de adultos (dente de siso) e o primeiro passo foi verificar se elas conseguiam se diferenciar em cultura em células neurais, isto é, se elas expressavam vários fatores que são característicos de células nervosas. É importante lembrar que existem vários tipos de células nervosas que são necessários para se recuperar a função sensorial e motora após uma lesão de medula. Uma vez confirmado que as CT da polpa dentária expressavam fatores característicos de diferentes células neurais elas foram transplantadas em ratos imediatamente após esses terem sido submetidos a uma secção total da medula espinhal. Para verificar se os resultados dependiam das propriedades das CT da polpa dentária e não da metodologia empregada os cientistas usaram como controles dois grupos de ratos submetidos ao mesmo experimento: no primeiro grupo injetaram CT da medula óssea e no segundo fibroblastos ( células derivadas da pele).
Quais foram os resultados?
Ratos que haviam sido transplantados com CT de polpa dentária humana – tanto de dente de leite, como adulto – mostraram uma recuperação muito superior à observada nos grupos injetados com CT de medula óssea ou fibroblastos. Essa melhoria foi observada logo após a operação durante a fase aguda da lesão medular. Cinco semanas após o transplante, os ratos com CT de polpa dentária eram capazes de locomover as patas traseiras de modo coordenado, enquanto os dois outros grupos só conseguiam movimentos sutis. De acordo com os pesquisadores, a observação de que os animais conseguiram recuperar os movimentos sugerem que as CT derivadas da polpa dentária foram capazes de promover também a regeneração dos axonios, as terminações nervosas que são projetadas a partir dos neurônios da medula espinhal.
Em resumo as perspectivas são otimistas
As CT derivadas de polpa dentária mostraram uma capacidade neuroregenerativa significante quando injetadas em ratos imediatamente após a secção da medula espinhal . Houve inibição da morte dos neurônios e células da bainha de mielina (a bainha que recobre as terminações nervosas) após a injúria, regeneração dos axonios (terminações nervosas) e substituição de oligodendrócitos lesionados (as células responsáveis pela formação e manutenção das bainhas de mielina) por oligodendrócitos maduros. Entretanto os pesquisadores reconhecem que esses resultados só foram obtidos imediatamente após a secção total da medula – o que certamente não poderá ser avaliado em seres humanos – e não sabemos quais seriam os resultados em diferentes lesões da medula. De qualquer modo essa pesquisa abre perspectivas muito otimistas.
Por Mayana Zatz
Resumo do VI COngresso Brasileiro de Células-tronco e Terapia Celular - 28/09 a 01/10

Entre os dias 28 de setembro e 01 de outubro ocorreu, em Salvador (BA), o VI Congresso Brasileiro de Terapia Celular e Células-Tronco promovido pela Associação Brasileira de Terapia Celular (ABTCel).
No primeiro dia houve uma reunião em que os coordenadores dos 8 Centros de Tecnologia Celular relataram quais os objetivos cumpridos até o momento, o que pretendem fazer e quais as principais dificuldades encontradas. Participaram desta reunião representantes do Ministério da Saúde, BNDES e de outros órgãos de fomento. Todos estes reforçaram que a terapia celular continua sendo prioridade do governo federal.
O evento contou com a presença dos principais pesquisadores brasileiros, pertencentes à RNTC, e de grandes nomes do cenário internacional.
Este ano observou-se um avanço nas pesquisas voltadas para a Biotecnologia, ou seja, produção de materiais ou componentes que possam auxiliar nos processos de cultivo das células-tronco ou na sua transformação em células especializadas, ou ainda na combinação destas células com biomateriais visando obter melhores estratégias para terapia.
Outro tipo de pesquisa muito presente este ano destinava-se a entender os mecanismos pelos quais as células-tronco atuam. Este processo é de extrema importância, pois poderá tornar os protocolos mais eficazes e obter melhores resultados, seja na pesquisa, seja na clínica.
Entre as doenças abordadas estão: Parkinson, engenharia de tecidos, doenças ósseas e regeneração, lesões medulares, doenças autoimunes, doenças cardiovasculares, da retina e nervo óptico, doenças renais e hepáticas.
Entre os testes clínicos em andamento, foram apresentados resultados sobre isquemia cerebral, lesão medular, doenças da retina e epilepsia. Todos são estudos em fase I, ou seja, estão avaliando apenas a segurança do procedimento em um pequeno grupo de pacientes. Nesta etapa do processo, os pesquisadores podem apenas dizer se o procedimento não trouxe algum efeito colateral aos pacientes. Felizmente nenhum dos estudos apresentou problemas. Agora é necessário esperar as próximas fases do estudo para podermos avaliar se a injeção das células promoveu alguma melhora no quadro dos pacientes.
O estudo relacionado ao tratamento de pacientes com cardiomiopatia dilatada, que é decorrência da Doença de Chagas, infelizmente não apresentou benefícios aos pacientes utilizando células mononucleares da medula óssea. Novos estudos precisam ser realizados e novos parâmetros devem ser escolhidos para que um novo estudo seja iniciado.
Um campo que vem se abrindo com intensidade cada vez maior é o das células de pluripotência induzida (iPS). Neste evento foram abordadas a modelagem de doenças como autismo e a esquizofrenia e a demonstração de que células cardíacas obtidas a partir de iPS possuem funcionalidade muito similar às células cardíacas que possuímos no corpo.
A geração de células iPS de pacientes com diferentes doenças mostra-nos que as células-tronco podem atuar em outros campos de estudo além da reposição celular; elas possibilitam também o estudo de novos medicamentos. Foi mostrado que as iPS geradas a partir de células de autistas e de pacientes com esquizofrenia, ao serem transformadas em neurônios, apresentam características muito similares às encontradas nos indivíduos e que foi possível reverter algumas destas características nas células em cultura. Ainda é muito cedo para se falar em tratamento, mas possuímos agora uma nova ferramenta para estudar doenças que ainda desafiam a medicina.
Caso queira ver o programa do evento e os palestrantes que estiveram presentes, clique aqui.
Daniel Cadilhe.
Cortando caminhos - Neurônios a partir da pele - Cell - 07/08/2011
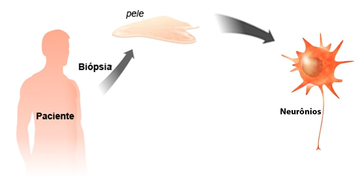
Em 2010, um grupo da Universidade de Stanford descreveu que era possível transformar células da pele de um camundongo diretamente em neurônios sem passar pelo estágio de célula pluripotente como é o caso das célulasiPS. Em maio de 2011 eles conseguiram reproduzir este feito com células humanas, mas apenas 2 a 4% das células eram reprogramas, ou seja, um percentual muito baixo.
No entanto, no último dia 04 de agosto, cientistas americanos do grupo do pesquisador Abeliovich conseguiram um resultado estupendo. Após testarem diversos fatores, conseguiram identificar um grupo capaz de aumentar a proporção de neurônios a partir de células da pele para 50%!
Os neurônios produzidos foram capazes de se comunicar com outros neurônios e, quando transplantados em cérebros de ratos, conseguiram se estabelecer no ambiente e se conectar com os neurônios residentes.
Além disso, eles também produziram neurônios através da pele de pacientes com Alzheimer familiar. Estes representam 5% dos casos da doença, pois os outros 95% são do tipo esporádico, ou seja, que pode acometer qualquer pessoa acima dos 60 anos. Já o familiar é de herança genética e a pessoa pode desenvolver o Alzheimer mesmo antes dos 60 anos e evoluir mais rapidamente.
Os pesquisadores já verificaram que os neurônios dos pacientes com Alzheimer apresentam anormalidades típicas da doença e isto pode ajudar a entender como ela se desenvolve.
Cada vez mais surgem células reprogramadas de diferentes doenças do sistema nervoso, o que nos possibilita trabalhar com neurônios de pacientes retirando apenas uma amostra de pele. Ainda há muito o que ser estudado, mas a ciência tem caminhado a passos largos em busca de respostas.
Daniel Cadilhe